Системное воспаление – типовой мультисиндромный, фазоспецифичный патологический процесс, развивающийся при системном повреждении и характеризующийся тотальной воспалительной реактивностью эндотелиоцитов, плазменных и клеточных факторов крови, соединительной ткани, а на заключительных этапах и микроциркуляторными расстройствами в жизненно важных органах и тканях.
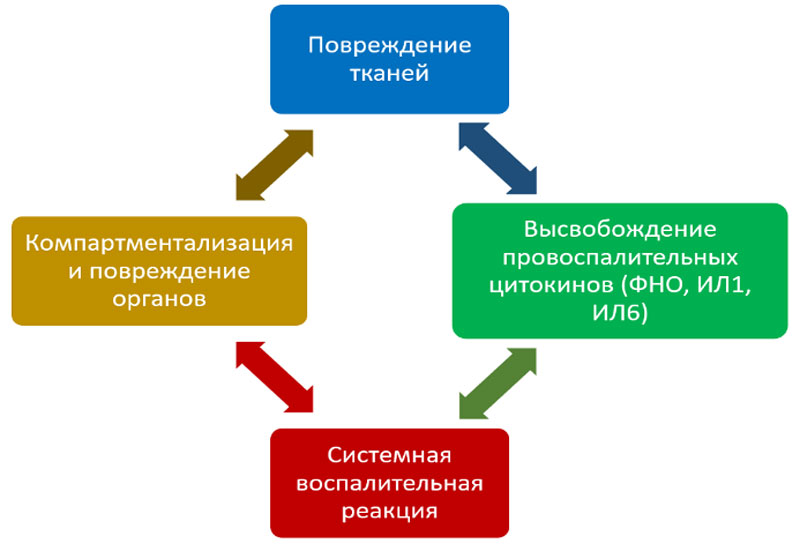
Патогенез системного воспалительного ответа сложен и еще исследуется и уточняется. Принципиальные аспекты патогенеза и формирование порочного круга представлено на рисунке.
Основные звенья патогенеза системного воспаления и формирование порочного круга
Системный воспалительный ответ неинфекционного генеза может развиваться в ответ на повреждение тканей и реализовываться при участии инфламмасом. Инфламмасомы представляют собой особый белковый комплекс, локализующийся в макрофагах и нейтрофилах, который приводит к запуску воспалительной реакции после контакта с паттернами микроорганизмов либо с эндогенными молекулами, образующимися при повреждении — DAMP (от англ. «danger-associated molecular patterns») или аларминами, способными связываться с TOLL-подобными или с NOD-подобными рецепторами.
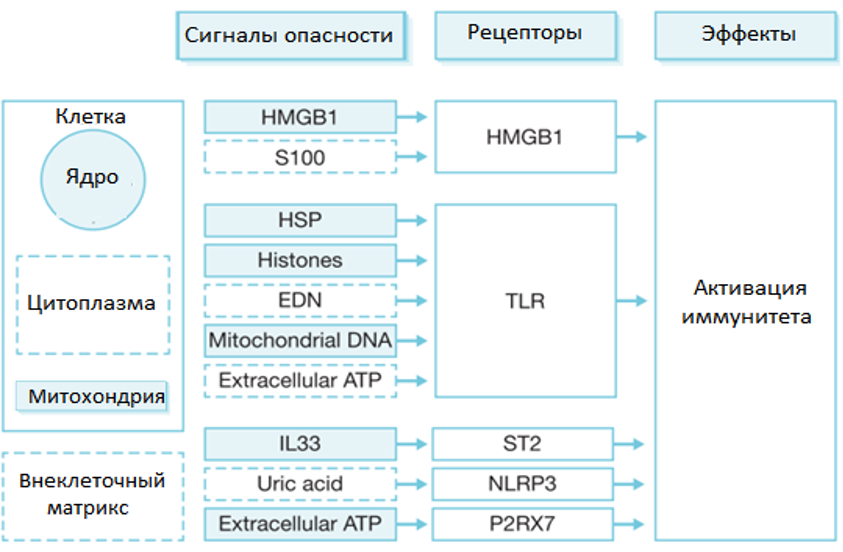
Отдельно либо содружественно с PAMP (от англ. «pathogen-associated molecular patterns») запускать врожденный иммунитет после повреждения тканей могут и алармины. Алармины выделяются при гибели клеток, активируют клетки врожденной иммунной системы, а также запускают адаптивный иммунный ответ. В конечном итоге алармины восстанавливают гомеостаз за счет стимулирования восстановления тканей, поврежденных в результате травмы либо воспаления. В качестве аларминов могут выступать HMGB1, S100s, кристаллы мочевой кислоты, IL-1 и т.д. Алармины, выделяясь из некротизированных или просто поврежденных клеток, запускают реакции местного и системного воспаления. Алармины, входя в состав инфламмасом, стимулируют выход провоспалительных цитокинов, в первую очередь интерлейкина-1β.
Одним из наиболее значимых аларминов считается HMGB1 (от англ. «high mobility group protein B1»), который может выступать как активный провоспалительный цитокин сам по себе, а также способен стимулировать продукцию провоспалительных цитокинов и хемокинов. В культуре моноцитов человека рекомбинантный HMGB1 вызывает выделение TNFα, IL-1α, -1β, -6, -8, MIP-1α, MIP-1β в количестве, эквивалентном септическим состояния. Таким образом, повреждение клеток любого генеза приводит к выходу во внеклеточное пространство значительного количества аларминов, сигналов опасности, которые могут связываться с соответствующими рецепторами (TLR, NLR, P2RX7 и т.д.), что, в свою очередь, будет приводить к стимуляции продукции и выброса цитокинов.
Выход компонентов клеток при их повреждении и участие в развитии иммунных реакций
Выброс провоспалительных белков и дисбаланс цитокинов являются наиболее важными компонентами развития системного воспалительного ответа. При этом продуцентами цитокинов являются не только клетки иммунной системы, но и клетки других органов и тканей (эндотелиоциты, кардиомиоциты, макрофаги, гепатоциты и т.д.).
Таким образом, определено ведущее значение иммунной системы в формировании системного воспалительного ответа. Гиперпродукция провоспалительных цитокинов, оксидативный стресс, протеазнный взрыв – важные патогенетические составляющие фазы первичного флогогенного удара системного воспаления. В этих процессах ключевую роль играет врожденная иммунная система.
Системой врожденного иммунитета распознаются высококонсервативные чужеродные структуры, называемые PAMPs (от англ. «патоген-ассоциированные молекулярные паттерны (образы)») через специфические, наследственно закодированные рецепторы PRRs (паттерн-распознающие рецепторы).
Среди сигнальных PRRs центральное место занимают чрезвычайно чувствительные Toll-like рецепторы (TLR), которые управляют целым рядом эффекторных функций (хемотаксис, фагоцитоз, респираторный взрыв, дегрануляция нейтрофилов, синтез эффекторных и регуляторных молекул), а так же регулируют адаптивный иммунный ответ. Имеется специфичность TLRs и их лигандов. Например, кроме липополисахарида (LPS), лигандами для TLR4 являются кристаллы мочевой кислоты, HMGB-1, кальций связывающим протеином A8, сывороточным амилоидом A. Белки теплового шока 60 (Hsp 60) и Hsp 70 являются лигандами для TLR2, TLR4 и CD14 и т.д.
Окисленные фосфолипиды, являясь побочным продуктом внутриклеточного окислительного взрыва, ингибируют активацию TLR и блокирует воспалительные реакции. Таким образом, становится все более очевидной высокая значимость рецепторов врожденного иммунитета, а именно TOLL-подобных рецепторов, не только в противоинфекционном иммунитете, но и в реализации воспаления (местного и системного) при состояниях, ассоциированных с ишемией, реперфузией, окислительным стрессом.
Общим конечным итогом в клетке является активации фактора транскрипции NF-κB, его миграция в ядро и стимуляция транскрипции многих провоспалительных генов, кодирующих синтез воспалительных регуляторных субстанций, включая провоспалительные цитокины: IL-1β, IL-6, IL-12, IL-18, IL-23, TNFα, хемокины и другие компоненты врожденного иммунитета. Моноциты и макрофаги, являясь основными носителями TLR и продуцентами цитокинов, вносят серьезный вклад в формирование гиперцитокинемии — важного патогенетического звена СВО.
Фактически DAMP являются провоспалительными медиаторами в значительной степени активируемыми в условиях клеточного стресса и повреждения, которые в свою очередь в конечном итоге могут приводить к клеточной гибели. Этими стимулами могут являться стерильные агенты продукты метаболизма собственных клеток, например кристаллы холестерина при атеросклерозе, или экзогенные токсины, например при асбестозе.
DAMP имеют решающее значение для инициации «стерильного» воспаления. При этом процесс ассоциируется с повышенной экспрессией эффекторных цитокинов, которая связана с адаптивной реакцией Т-клеток. Быстрая реакция клеток выбросом цитокинов в ответ на воздействие указывает на их высокую значимость в патогенезе неинфекционного воспаления.
Цитокины оказывают не только локальное действие, характеризующееся активацией комплекса сосудистых и тканевых изменений в зоне воспаления, но, попадая в кровоток, обладают дистантным действием и вызывают развитие системных реакций. Системная воспалительная реакция носит, с одной стороны, компенсаторно-приспособительный характер, с другой стороны, при чрезмерной выраженности этих процессов развивается комплекс реакций повреждения и дезадаптации. При этом решающую роль в выраженности эффектов цитокинов и, соответственно, направленности их (протективное или повреждающее), играет степень дисбаланса цитокинов и цитокинового шторма. Так, TNFα, IL-1, IL-6, воздействую на центр терморегуляции вызывают повышение температуры тела с лихорадкой, что является протективной реакцией организма.
Те же цитокины могут стимулировать продукцию лейкоцитов в костном мозге. IL-1 и IL-6 являются мощными стимуляторами продукции белков острой фазы (например, С-реактивного белка) печенью. Вместе с тем, чрезмерно высокие уровни провоспалительных цитокинов могут вызывать неблагоприятные эффекты. Например, большие количества TNF приводят к снижению сердечного выброса, повышенной проницаемости сосудов, усилению тромбообразования, метаболическим нарушениям, связанным с развитием резистентности к инсулину, т.е., в конечном счете, к развитию шока.
Следующим значимым фактором патогенеза системного воспаления, определяющим повреждающие эффекты, является окислительный стресс (ОС). Основными повреждающими факторами, определяющими развитие ОС, являются гипоксия (ишемия), воспалительная и стрессорная реакция. Антиоксидантный потенциал больных часто оказывается недостаточным для компенсации развивающихся нарушений.
Антиоксидантная система играет ключевую роль в защите тканей от ишемического повреждения (супероксиддисмутаза, гемоксигеназа, каталаза, глютатионпероксидаза, глютатионредуктаза). Одной из причин оксидативного стресса может быть снижение эффективности этой системы. Например, при ишемии-реперфузии происходит торможение активности антиоксидантной системы, снижение уровня токоферола, запускается перекисное окисление липидов. Таким образом, в тканях отмечается резкий дефицит антиоксидантов, что служит пусковым моментом в запуске ОС. Восстановление перфузии тканей приводит к активному поступлению кислорода и глюкозы в клетки, вызывая резкую интенсификацию процессов свободнорадикального окисления и/или снижение резерва антиоксидантной защиты, результатом чего будет значительное накопление активных форм кислорода (АФК).
В свою очередь АФК, в частности Н2О2, индуцируют появление однонитевых разрывов ДНК, которые усиливают экспрессию главного проапоптотического белка р53, приводя к апоптотической гибели клеток. Кроме того, активные формы кислорода обуславливают запуск программы апоптоза по митохондриальному пути с высвобождением растворимых межмембранных белков. Среди них имеется ряд ключевых апоптогенных факторов: цитохром С, прокаспазы-2, -3 и -9, белок AIF и эндонуклеаза G.
Наряду с активными формами кислорода, существенную роль в патологических процессах играют активные формы азота и их метаболиты. Окись азота (NO) – внутренняя регуляторная молекула, включенная в ряд физиологических процессов, как, например, регулирование тонуса сосудов и пролиферацию гладкомышечных клеток. NO синтезируется во всех типах клеток, в том числе эндотелиальных и кардиомиоцитах, из L-аргинина с помощью трех изоформ NO-синтаз (NOS). Две изоформы (eNOS и nNOS) постоянно экспрессируются и строго регулируются кальцием-кальмодулином и фосфорилированием, в то время как третья форма (iNOS) индуцируется в процессе воспаления и производит высокие уровни NO в течение более длительного периода.
В патологических условиях происходит перегрузка клеток ионизированным кальцием. Этот процесс опосредован через нарушение проводимости кальциевых каналов, либо через высвобождение ионизированного кальция из эндоплазматического ретикулума в цитозоль. Повышение в цитоплазме ионизированного кальция приводит к пермеабилизации мембраны митохондрий и запуску апоптоза по митохондриальному пути. Ионы кальция участвуют в развитии апоптоза путем прямой активации Са2+, Mg2+-зависимой эндонуклеазы и последующей межнуклеосомной деградации ДНК.
Было установлено, что лизосомы наравне с клеточным ядром и митохондрией играют важную роль в апоптотической гибели клеток. Ряд факторов (активные формы кислорода, гипоксия, перегрузка клеток кальцием, цитокины, перерастяжение кардиомиоцитов) прямо или косвенно стимулируют пермеабилизацию лизосомальных мембран и высвобождение в цитозоль катепсинов – цистеиновых лизосомальных протеиназ. В цитозоле катепсины могут запускать клеточную смерть различными путями, включая активацию каспаз, высвобождение проапоптотических факторов из митохондрий, а также расщепление антиапоптотических белков семейства Всl-2, и Вid.
Катепсины являются непосредственными исполнителями апоптоза, в основе которого лежит протеолиз, обусловленный цистеиновыми протеазами типа каспаз, катепсинов, гранзима, калпаина. В частности, катепсин D является основным посредником между стимулами апоптоза и белком p53, TNF и IFNγ. Лизосомальная дезинтеграция с выходом катепсина D в цитозоль и митохондриальная – с выходом цитохрома С – считаются начальными стадиями апоптоза.
Способность макрофагов выделять эластолитические протеолитические протеазы предполагает, что они могут использовать катепсины для миграции через артериальную стенку. Адгезия и миграция моноцитов, их превращение в макрофаги играют важную роль в патогенезе воспаления, в том числе возникающего в поврежденных тканях. Эти клетки могут использовать внеклеточные цистеиновые протеазы в качестве вспомогательных инструментов миграции.
Известно, что недостаток катепсина S приводит к снижению количества макрофагов, Т-клеток, и понижению уровня IFNγ. Кроме того, кроме непосредственного участия катепсинов в процессе воспаления, возможно их косвенное участие через снижение экспрессии TGFβ.
В литературе имеются данные о взаимоотношении матриксных металлопротеиназ и катепсинов. Так, известно, что макрофаги синтезируют ММР-7, ММР-9 и катепсины B, L, S. При этом только катепсины выявляются в межклеточном пространстве. Ингибирование катепсинов L и S (но не ММР) полностью блокировало макрофагальную эластолитическую активность. Таким образом, доказывается роль катепсинов как наиболее мощных макрофагальных эластаз. Матриксные металлопротеиназы вовлечены в процесс иммунного ответа на патоген, но также они могут участвовать в неконтролируемом повреждении тканей. Известно, что при сепсисе достоверно повышается уровень proMMP-1 и MMP-1, при этом повышенный уровень коррелирует со смертностью. В экспериментальных исследованиях установлено, что при сепсисе MMP-1 активно синтезируется эндотелиальными клетками. Блокирование MMP-1 приводит к уменьшению повреждения эндотелиального барьера, дессиминированного внутрисосудистого свертывания, проницаемости сосудов легких и цитокинового шторма при сепсисе.
Воздействие ММР-1 и ММР-3 на макрофаги приводит к быстрому высвобождению TNFα, который был заблокирован ингибиторами матриксных металлопротеиназ. Синтез и выброс ММР-9 макрофагами зависит от TNFα и простагландинов. Потенциальная возможность ММР-1 и ММР-3 регулировать секрецию макрофагами простагландинов и ММР-9 указывает на их важную роль в патогенезе воспаления. Кроме того, ММР-9 участвует в слущивании ICAM-1 с поверхности клеток. Интересно участие матриксной металлопротеиназы 9 в развитии воспаления при церебральной ишемии. При этом одним из основных триггеров восплительного процесса считается выход аларминов, в первую очередь HMGB-1, в межклеточное пространство из поврежденных клеток. Установлено, что HMGB-1 вызывает активацию выброса ММР-9, причем происходит это через рецепторы TLR-4. Кроме того, в экспериментах in vitro было установлено, что ММР-9 ответственна за стимуляцию выброса провоспалительных медиаторов, а также за индукцию апоптоза эндотелиальных клеток. Таким образом, ключевую роль в развитии системного воспаления играют такие факторы как протеазный взрыв, оксидативный стресс и дисбаланс цитокинов («цитокиновый шторм»).
Важным участником активации ранних воспалительных реакций и СВО признан триггерный рецептор, экспрессированный на миелоидных клетках-1 (TREM-1). Он впервые описан как активирующий рецептор воспалительного ответа. Отличительная особенность TREM-1, делающая его привлекательным для изучения в аспекте СВО, связана с его способностью к активации всех эффекторных функции врожденного иммунитета и многократному усилению продукции цитокинов при совместной стимуляции с главными рецепторами врожденного иммунитета (Toll-подобные рецепторы и Nod-подобные рецепторы). До недавнего времени TREM-1 считался маркером сепсиса и инфекционного СВО. Умеренное повышение мембранной и растворимой формы TREM-1 (sTREM-1) наблюдается во время инфекций, вызванных бактериями, вирусами и грибами, а значительное увеличение – при сепсисе и септическом шоке. Однако за последние несколько лет появились исследования, указывающие на связь TREM-1 с СВО неинфекционного генеза.
Связывание TREM-1 с лигандом вызывает сильную и немедленную активацию всех эффекторных механизмов, приводя к выраженной дегрануляции и респираторному взрыву нейтрофилов, умеренной стимуляции фагоцитоза, повышению продукции провоспалительных цитокинов, хемокинов и ингибированию синтеза IL-10.
Растворимая форма sTREM-1 высвобождается c поверхности клеток путем шеддинга (слущивания) мембранной формы матриксными металлопротеиназами и является естественным рецептором-ловушкой, который, конкурируя за лиганд с мембранной формой TREM-1, снижает его активацию.
В патогенезе системного воспалительного ответа важно участие эндокринной системы, особенно в отношении взаимной регуляции с иммунной системой. Активация гипаталамо-гипофизарно-надпочечниковой и симпатоадреналовой систем с выходом большого количества кортизола и катехоламинов, по-видимому, приводит к нарушению баланса Th1/Th2 клеток. Предполагается, что ключевую роль в регуляции иммунных нарушений играет снижение экспрессии и сигналинга IL-12 и повышение экспрессии T-регуляторных клеток (Treg). Кроме того, цитокины, продуцируемые Th2 повышают экспрессию аргиназы 1 в миелойдных супрессорных клетках, приводя, тем самым, к дефициту аргинина, что в дальнейшем снижает функциональную активность лимфоцитов.
На ранних этапах развития ССВО большое количество лейкоцитов прикрепляется к активированным эндотелиальным клеткам стенок сосудов, что может нарушать миркроциркуляцию. Отчасти адгезия лейкоцитов связана с повышенной экспрессией молекул адгезии на поверхности эндотелиальных клеток, к которой приводят высокие уровни медиаторов воспаления, таких как TNFα и IL-1. Помимо механического закупоривания микроциркуляторного русла, активированные лейкоциты могут повреждать окружающие эндотелиальные клетки и периваскулярные ткани. В результате развивается дисфункция эндотелия.
Активированные эндотелиальные клетки экспрессируют несколько факторов (например, тканевой фактор, молекулу адгезии тромбоцитов к эндотелиальным клеткам, тромбоксан), которые преобразуют их локальный коагулянтный статус из нейтрального в прокоагулянтный. Кроме этого, TNFα запускает каскады коагуляции путем активации внешних путей. Фактор XIIa запускает как внутренний путь свертывания крови посредством активации фактора XI, так и побуждает эндотелиальные клетки и макрофаги продуцировать тканевой фактор, который, в свою очередь, активирует внешний путь коагуляции. Возможно повышение уровней тканевого активатора плазминогена (tPA) в плазме, которое быстро уравновешивается высвобождением ингибитора активатора плазминогена (PAI) При развитии сепсиса уровни протеина C и антитромбина III в плазме снижаются, а уровень PAI-1 в плазме повышается.
Тромбомодулин плазмы, который образуется в результате деградации тромбомодулина мембран эндотелиальных клеток, также увеличивается при ССВО. Процессу нарушению коагуляционного гемостаза способствует множественное действие тромбина и нарушение естественных ингибиторных механизмов, таких как антитромбин III, протеин S, протеин С и плазменные ингибиторы фибринолиза. Эта прокоагулянтная среда в сочетании с повреждением эндотелиальных клеток предрасполагает к развитию чрезмерного количества микротромбов, дополнительно затрудняя местный кровоток и усугубляя дисфункцию органов-мишеней. Эти потенциально деструктивные местные и системные реакции при ССВО (повышенная периферическая вазодилатация, чрезмерная проницаемость микрососудов, ускоренное свертывание в микрососудах, активация лейкоцитов/эндотелиальных клеток) способствуют развитию глубоких патологических изменений в различных органах и считаются основными этиологическими факторами при развитии септического шока, диссеминированного внутрисосудистого свертывания крови (ДВС), острого респираторного дистресс-синдрома (ОРДС) и других дисфункций органов-мишеней, приводящих к синдрому полиорганной недостаточности (СПОН).
В развитии и поддержании системного воспалительного ответа значительную роль играет компартментализация. Воспаление является типовым патологическим процессом, однако события, связанные с ним, в различных органах имеют отличия. Дисбаланс цитокинов в системном кровотоке, развивающийся при системном воспалительном ответе, является отражением сложной сети разнонаправленных регулирующих сигналов, модулируемых специфическими клетками микроокружения и различающихся в зависимости от компартмента. Исходя из этого представления ткани могут являться источником биологически активных веществ, инициирующих и поддерживающих системное воспаление за счет дистантного действия и вовлечения в процесс отдаленных органов. При этом триггером местного «стерильного» воспаления является ишемия/реперфузия, окислительный стресс, апоптотическое, некротическое, механическое повреждение тканей.
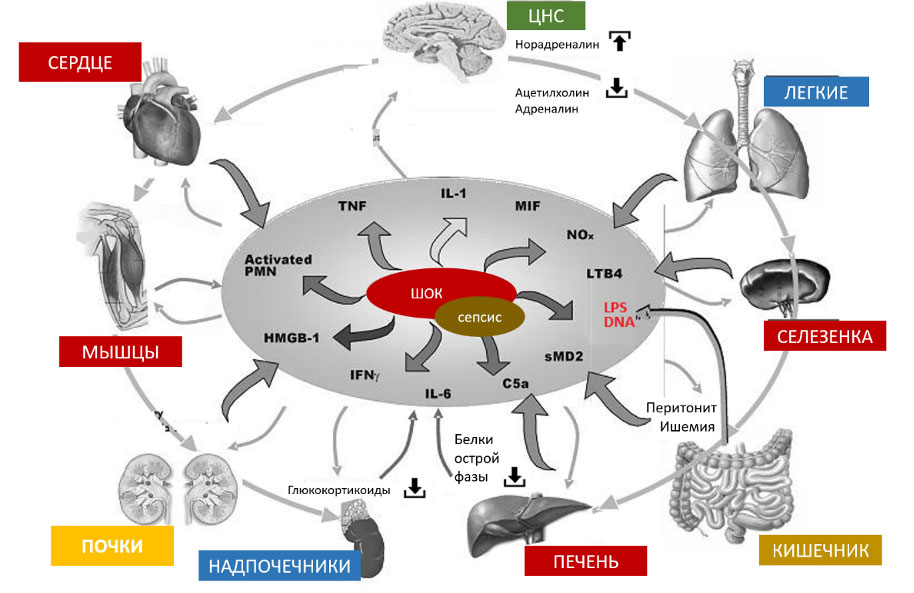
Таким образом, за счет развития микроциркуляторных расстройств, нарушений гемостаза, вовлечения отдаленных органов в патологический процесс, системный воспалительный ответ может иметь неблагоприятное течение с формированием изолированных органных дисфункций или полиорганной недостаточности. При этом сам ССВО в качестве противовеса имеет систему компенсаторную противовоспалительного ответа (КПВО). Считается, что за развитие ССВО отвечает система врожденного иммунитета, а КПВО обеспечивается активностью адаптивной иммунной системы.
IL-10 является ключевым цитокином противовоспалительного ответа и продуцируется CD4+ Th2-клетками, моноцитами и B-клетками. Именно этот цитокин является главным в попытке иммунного ответа контролировать гипервоспаление.
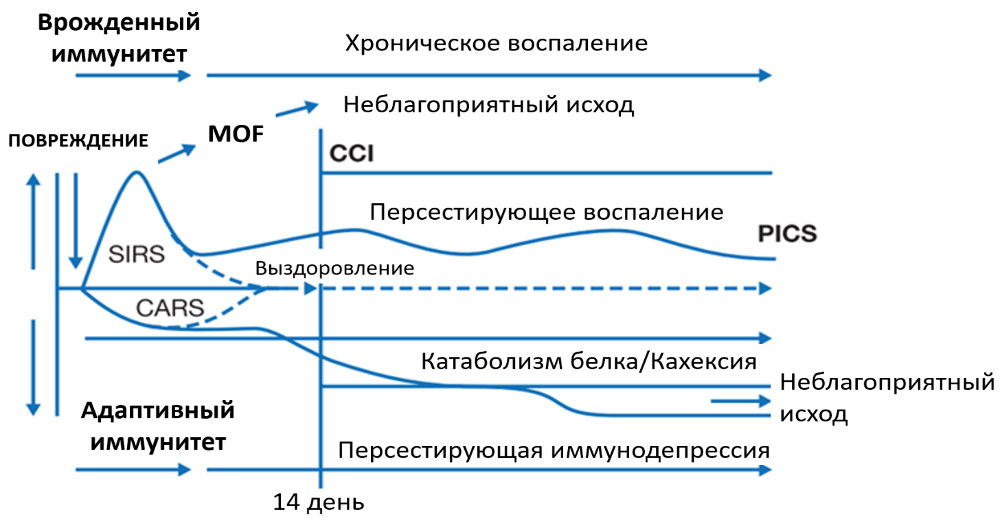
Возможные взаимоотношения, а также варианты исходов клинического течения в зависимости от преобладания актвиности той или иной системы представлены на рисунке.
Модель взаимоотношения систем воспалительного ответа и противовоспалительного ответа, а также варианты клинических исходов
CCI — хроническое критическое заболевание, MOF — полиорганная недостаточность, PICS — синдром стойкой иммуносупрессии и катаболизма, SIRS — синдром системного воспалительного ответа, CARS — компенсаторный противовоспалительный ответ (адаптировано из J Trauma Acute Care Surg. 2014 Jan; 76(1): 21–30. DOI:10.1097/TA.0b013e3182ab1ab5).
Так, при гиперэргическом воспалительном ответе и полной несостоятельности противовоспалительной системы, а также стремительном течении возможно развитие полиорганной недостаточности, приводящей к смерти пациента. При недостаточной эффективности противовоспалительной системы, но при выраженном воспалительном ответе течение заболевания затягивается, что может привести к персистирующему хроническому воспалению с иммуносупрессией и катаболическим синдромом. С другой стороны, при явном преобладании противовоспалительной системы и, соответственно, активности адаптивной иммунной системы, возможно развитие прогрессивной иммуносупрессии, а при умеренном дисбалансе с преобладанием противовоспалительной системы – усиление катаболизма белков, кахексии и, в самых неблагоприятных случаях, смерти в отдаленном периоде.
Таким образом, баланс воспалительной (врожденный иммуннитет) и провоспалительной (адаптивный иммуннитет) систем является ключевым для течения ССВО и быстрого выздоровления, либо затяжного течения и развития неблагоприятных исходов в случае дисбаланса этих систем.
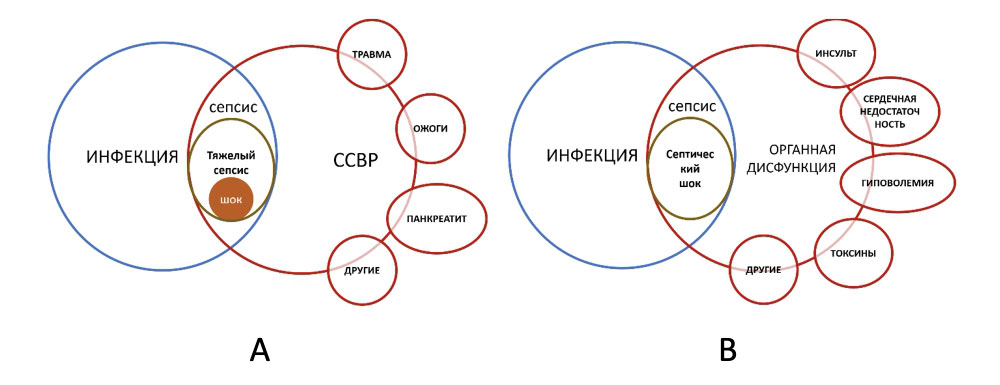
Сам термин «синдром системного воспалительного ответа – ССВО» (от англ. «Systemic inflammatory response syndrome» или SIRS) был принят в 1992 году на заседании Согласительной комиссии Американского колледжа пульмонологов и Общества критической медицины. Тогда же было определено, что этот термин предпочтительнее термина сепсис при описании распространенного воспаления (или клинической реакции на это воспаление), которое может возникнуть у пациентов с такими разнообразными заболеваниями, как инфекция, панкреатит, ишемия, множественная травма, геморрагический шок и т.д., а также опосредованными активностью иммунной системы повреждениями органов. Термин «сепсис», подкатегория дисфункции, которая была определена как ССВО, следует использовать только для пациентов с подтвержденной инфекцией. То есть, сразу было проведено разделение генерализованных воспалительных реакций, ассоциированных с инфекционными агентами, и без таковых.
Основанием для диагностики ССВО было определено наличие двух или более представленных клинико-диагностических критериев:
- температура тела более 38°С или менее 36°С;
- частота сердечных сокращений более 90 уд/мин;
- частота дыхания более 20 в минуту;
- уровень лейкоцитов крови более 12*109/л или менее 4*109/л;
- содержание молодых форм гранулоцитов более 10%.
Критерии диагностики были приняты в 1992 году и до сих пор для многих клинических специалистов являются определяющими. Однако со временем стало очевидно, что постановка диагноза на основании этих критериев представляет трудности. Кроме того, эти критерии были описаны при диагностике сепсиса, а не «асептического» ССВО.
Недостатком предлагаемого способа диагностики ССВО, например, применительно к пациентам после полостных оперативных вмешательств является то, что тахикардия и тахипноэ в большинстве клинических ситуаций не являются диагностически значимыми в виду проводимой противоаритмической терапии и продленной искусственной вентиляции легких. На температуру тела в значительной степени влияет применение анальгетиков, обладающих жаропонижающим эффектом. После проведенной операции со значительным повреждением тканей и органов лейкоцитоз со сдвигом формулы влево является естественной реакцией, а не проявлением осложненного ССВО.
Важно отметить сложные взаимоотношения системного воспаления, инфекции и полиорганной недостаточности. ССВО может быть ассоциирован с большим количеством патологических состояний, таких как травма, ожоги, панкретит, ишемия, геморрагический шок и т.д.
Действительно, системный воспалительный ответ нельзя рассматривать как синоним сепсиса или даже просто инфекционного процесса. Если для генерализованной инфекции, к которой относится и сепсис, системная воспалительная реакция является обязательным и непременным атрибутом, то локализованный процесс может протекать и без явлений системного воспаления. Существует масса примеров запуска ССВО без инфекционного компонента. В частности к таким ситуациям может относиться управляемая ишемия и реперфузия, сопровождающая проведение операции по реваскуляризации миокарда, когда кроме ишемии/реперфузии существует большое количество триггеров, к которым относятся механическое повреждение тканей с выходом большого количества аларминов, повреждение клеток вследствие развившегося окислительного стресса, контакт иммунокомпетентных клеток с большим количеством чужеродных материалов (трубок системы ИК, фильтров, оксигенаторов и т.д.), использование большого количества фармацевтических препаратов для проведения наркоза, кардиоплегии, поддержания функции жизненно важных органов.
Кроме того, провоцировать системное воспаление может назначение препаратов, обладающих высокой медиаторной активностью, таких как фактор некроза опухоли и других цитокинов. Возможными осложнениями могут быть острый респираторный дистресс-синдром, шок, почечная недостаточность, полиорганная недостаточность.
Предложенные критерии для диагностики ССВО и сепсиса были применены в клинике и, как результат, расширили знания о патогенезе, а также о прогнозе заболевания. Вместе с тем, стала очевидной необходимость в расширении критериев диагностики, в том числе, за счет биохимических и иммунологических показателей. В результате в 2001 году была проведена международная конференция по сепсису (2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference), на которой было определено, что
1) имеющаяся концепция по сепсису, тяжелому сепсису и септическому шоку остается приемлемой как для клиницистов, так и для исследователей;
2) имеющиеся определения этих состояний не позволяют точно определять стадию или прогнозировать реакцию хозяина на инфекцию;
3) хотя ССВО (SIRS) остается полезной концепцией, диагностические критерии, опубликованные в 1992 г., слишком чувствительны и неспецифичны;
4) расширенный список признаков и симптомов сепсиса может лучше отражать клиническую реакцию на инфекцию
Было предложено ввести ряд диагностических критериев системного воспаления в ответ на инфекцию.
Диагностических критериев системного воспаления в ответ на инфекцию

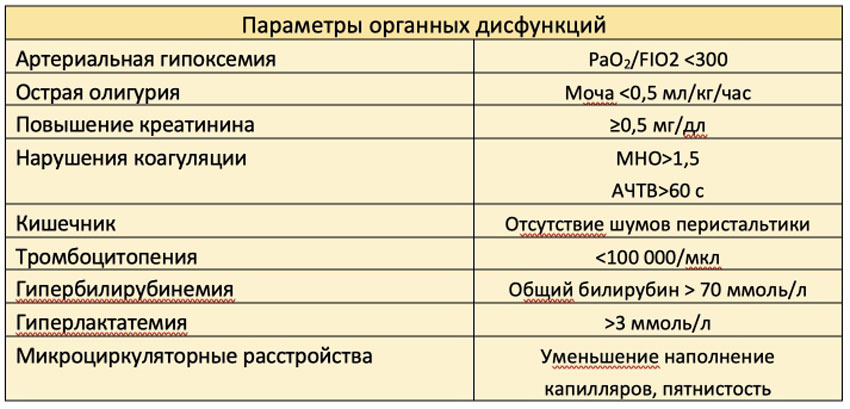
В конечном счете, эта схема направлена на систематизацию физических и лабораторных данных, которые побуждают опытного клинициста сделать вывод, что пациент «выглядит септическим». Вместе с тем, ни один из параметров не является специфическим для сепсиса.
Таким образом, ССВО неспецифичен для инфекции, и его полезность в качестве инструмента скрининга на сепсис ограничена высокой распространенностью этих аномалий у госпитализированных пациентов. Приравнивание ССВО к сепсису может способствовать чрезмерному и необоснованному использованию антибиотиков и назначению инфузионной терапии. С патофизиологической точки зрения теперь считается, что сепсис представляет собой дисрегуляцию реакции организма на инфекцию, тогда как ССВО представляет собой нормальный физиологический ответ на инфекцию, который может быть адаптивным.
Все эти измененные представления привели к тому, что в 2016 году была проведен Третий международный Консенсус по определению сепсиса и септического шока (Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)). Было принято решение не уделять внимание ССВО при определении сепсиса и вместо этого сосредоточиться на дисфункции органов. Считалось, что септический шок — это нечто большее, чем просто сепсис с рефрактерной гипотонией или сердечно-сосудистой дисфункцией, требующий также признаков клеточных или метаболических нарушений.
В результате были внесены изменения в определения терминов, определяющих септические и воспалительные состояния. В частности, сепсис определен как «опасная для жизни дисфункция органа, вызванная разрегулированной реакцией организма на инфекцию». Септический шок – «подгруппа сепсиса, при которой особенно серьезные нарушений кровообращения, клеточные и метаболические нарушения ассоциированы с более высоким риском смерти, чем только при сепсисе». Принципиальные отличия по изменениям в терминологии и взаимоотношении критических состояний представлены на рисунке (Рис.65).
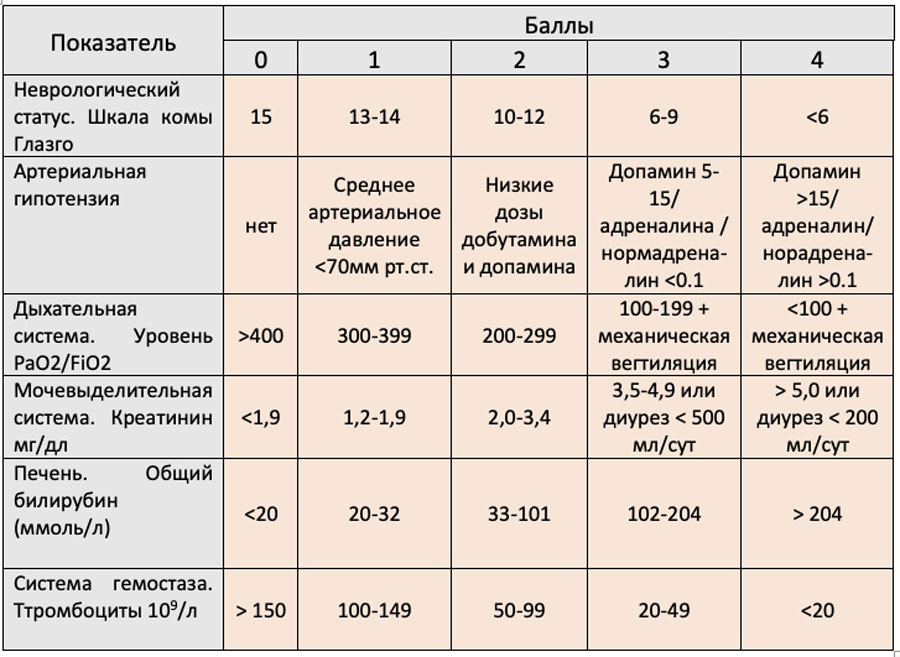
Поскольку новые определения сепсиса смещают акцент с синдрома системного воспалительного ответа на органные дисфункции, было предложено использовать последовательную шкалу оценки органных дисфункций (Sequential Organ Failure Assessment (SOFA)), как простой проверенный метод количественной оценки дисфункции органов, а также потребность в вазопрессорной терапии для поддержания системного давления и повышение уровня лактата в отсутствие гиповолемии, для диагностики септического шока.
Диагноз сепсиса устаналивается при наличии документированной (предположительной) инфекции и ≥2 баллов по шкале SOFA.
Шкала полиорганной недостаточности связанная с сепсисом (шкале SOFA)
Кроме того, новые критерии определения сепсиса предлагают шкалу быстрая SOFA для эффективного скриннинга у постели больного для выявления потенциальных инфицированных пациентов с риском неблагоприятных исходов вне стационара, отделениях неотложной терапии и общесоматических отделениях. Критерии быстрой SOFA включают (≥2 баллов идентифицируют пациентов с высоким риском неблагоприятных исходов):
- Систолическое давление ≥100 мм рт.ст;
- Частота дыхания ≥22 в минуту;
- Изменения психического состояния.
И, наконец, критериями септического шока определено считать:
- Стойкая артериальная гипотензия после введения жидкостей, а также
- Потребность в вазопрессорах, а также
- Лактат >2 ммоль/л при отсутствии гиповолемии.