Специфический гуморальный иммунный ответ слизистых оболочек формируют секреторные антитела класса А (sIgA).
Большинство слизистых оболочек, особенно слизистые оболочки I типа в кишечнике и легких, по своей природе являются «хрупкими», так что они легко могут быть повреждены продуктами патогенов во время развития воспалительных реакций. По этой причине иммунитет слизистой оболочки в значительной степени формируют секреторные антитела и, в первую очередь, секреторный иммуноглобулин класса А (sIgA). Эти антитела являются ключевыми компонентами слизи и других жидкостей организма барьерных тканей, таких как слюна и слезная жидкость, и защищают от патогенных микроорганизмов. Хотя sIgM присутствует в некоторых жидкостях организма, подавляющее большинство секреторных антител – это sIgA. Мыши, неспособные продуцировать sIgA из-за нарушения С альфа-экзона или дефектов синтеза J-цепи, демонстрируют повышенную восприимчивость к инфекции и неблагоприятным изменениям состава микробиоты. Секреторный IgA имеет несколько особенностей, которые делают его идеальным для защиты слизистой оболочки. Во-первых, sIgA конститутивно локализуются в слизи, для нейтрализации практически любого патогена или токсина, способного вступить в контакт с эпителием. Во-вторых, независимо от антигенной специфичности, углеводные фрагменты С-доменов молекул sIgA могут связываться с молекулами адгезии, экспрессируемыми многими патогенами. В-третьих, по крайней мере, в кишечнике около половины всех антител sIgA обладают способностью перекрестно реагировать с большим количеством эпитопов. Это означает, что более широкому спектру угроз можно противостоять с помощью меньшего количества антител. В-четвертых, sIgA не являются эффективными активаторами комплемента, что снижает вероятность активации этого каскада и инициации повреждающего воспаления при формировании комплексов антиген-антитело. В-пятых, sIgA обладает высокой устойчивостью к широкому спектру протеаз хозяина и микробов, в том числе, в кишечнике млекопитающих.
Механизмы выработки sIgA слизистой оболочки
Энтероциты, взаимодействуя с комменсальными бактериями, продуцируют цитокины, которые индуцируют продукцию В клетками sIgA
Выработка sIgA в организме намного превышает выработку антител любого другого изотипа. В среднем, в кишечнике взрослого человека ежедневно синтезируется около 2-3 граммов sIgA. sIgA-продуцирующие плазматические клетки присутствуют в кишке даже в отсутствие патогенов из-за влияния микробиоты на В-клетки слизистой. Постоянная продукция sIgA держит численность комменсалов под контролем, защищая слизистые оболочки и поддерживая гомеостаз.
В случае Т-зависимых реакций, cDC способствуют формированию высокоаффинных IgA не только к комменсальной микробиоте, но и к патогенам и их токсинам. cDC в Пейеровых бляшках регулируют процессы переключения класса синтезируемых антител на IgA, а также экспрессию рецепторов «хоуминга» в ткани слизистых на IgA продуцирующих плазматических клетках и их предшественниках.
Энтероциты слизистых оболочек также играют важную роль в продукции sIgA (Рис.94). Когда энтероциты с помощью PRR (особенно TLR2) связываются с комменсальными бактериями, это вызывает продукцию цитокинов BAFF (от англ. «B-cell-activating factor belonging to the TNF family»), APRIL (от англ. «a proliferation inducing ligand») и IL-10, которые индуцируют в 80% активированных В-клеток lamina propria переключение изотипа иммуноглобулинов именно на IgA.
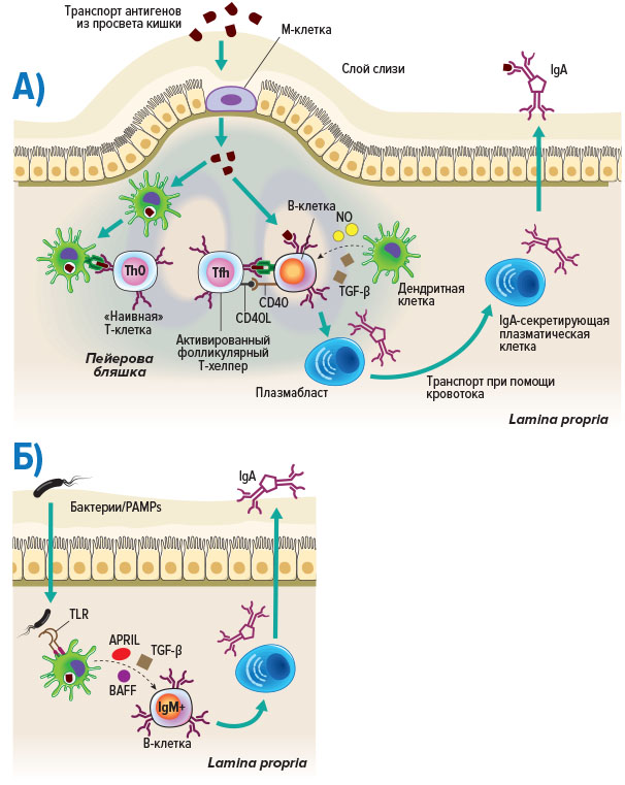
A. Переключение на IgA происходит при связывании APRIL (DCs и эпителий) с TACI –рецептором на В-клетках. Эпителиальные клетки кишечника также продуцируют TSLP, который стимулирует продукцию APRIL дендритными клетками.
Эпителий и DCs продуцируют TGF-β. TLR лиганды, производимые комменсальными бактериями также индуцируют выработку NO, который тоже способствует выработке IgA. Наконец, выработка IgA зависит от ретиноевой кислоты, которая производится клетками эпителия и DCs, экспрессирующими ретинолдегидрогеназу RALDH.
B. Переключению класса IgA способствуют сигналы от TLR.
Энтероциты также выделяют TSLP, который усиливает выработку BAFF, APRIL и IL-10. Кроме того, cDC2, которые находятся в куполе Пейеровых бляшек мышей, секретируют высокие уровни IL-10. Презентация DCs антигенов в присутствии IL-10 индуцирует поляризацию «наивных» Т лимфоцитов в Tfh; регуляторные Т-клетки, секретирующие TGFβ и IL-10; и Th2-эффекторы, синтезирующие IL-4, IL-5 и IL-10. Одновременно поляризация в Th1 и продукция IFNg подавляются. При распознавании TLR5 флагеллина, DCs начинают экспрессировать фермент ретинолдегидрогеназу, который конвертирует витамин А в ретиноевую кислоту. Ретиноевая кислота, TGFβ и IL-10 направляют переключение изотипов иммуноглобулинов в активированных В-клетках в сторону IgA. В-лимфоциты циркулируют через лимфу и кровь в эффекторные сайты слизистой оболочки (напр. мезентериальные лимфоузлы). В этих местах активированные В-клетки завершают свою дифференцировку в зрелые IgA-продуцирующие плазматические клетки.
Плазматические клетки секретируют полимерный IgA вблизи базолатеральной поверхности эпителиальных клеток, выстилающих кишечник, а также клеток, образующих экзокринные железы. Полимерный IgA связывается с поли-иммуноглобулиновым рецептром или pIgR (от англ. «poly-Ig receptor») на базальной поверхности клеток эпителия в эффекторных участках слизистой оболочки и переносится при помощи трансцитоза на апикальную поверхность клеток. При экзоцитозе pIgR расщепляется таким образом, что секреторный компонент остается прикрепленным к антителу, что приводит к высвобождению комплекса sIgA в слизь (Рис.95)
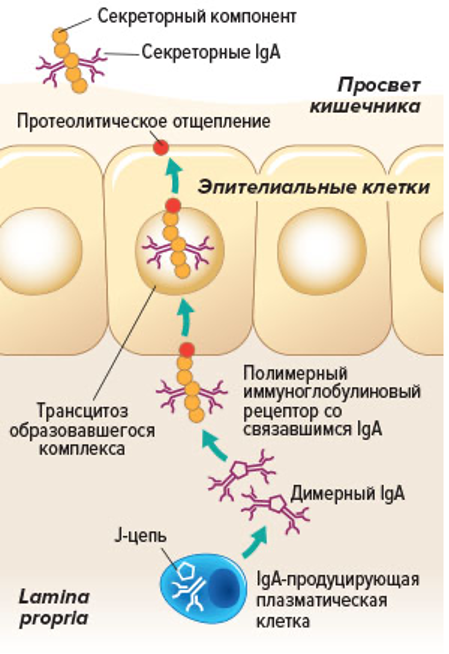
IgA транспортируются с базальной на апикальную поверхность эпителия. IgA продуцируется в ламина проприа в форме димера, Fc-фрагменты мономеров, которого ковалентно связаны с J цепью. Димерный IgA транспортируется из ламина проприа в просвет кишечника. Этот транспорт осуществляется с помощью poly-Ig рецептора на базальной и апикальной поверхности эпителиальных клеток. Секреторный компонент связывается с бактериями и снижает их подвижность.
Плазматические клетки мыши продуцируют только один подкласс IgA, но у человека продуцируется IgA1 и IgA2, которые отличаются IgA транспортируются с базальной на апикальную поверхность эпителия. IgA продуцируется в ламина проприа в форме димера, Fc-фрагменты мономеров, которого ковалентно связаны с J цепью. Димерный IgA транспортируется из ламина проприа в просвет кишечника. Этот транспорт осуществляется с помощью poly-Ig рецептора на базальной и апикальной поверхности эпителиальных клеток. Секреторный компонент связывается с бактериями и снижает их подвижность.
Плазматические клетки мыши продуцируют только один подкласс IgA, но у человека продуцируется IgA1 и IgA2, которые отличаются некоторыми своими свойствами. В то время как выработка IgA1 происходит как системно, так и на слизистых, IgA2 присутствует главным образом на слизистых поверхностях (особенно в дистальном отделе кишечника и урогенитальном тракте). Благодаря более короткой области шарнира IgA2 более устойчив, чем IgA1, к деградации протеазами, что позволяет этому антителу обеспечивать устойчивую защиту в суровой биохимической среде.
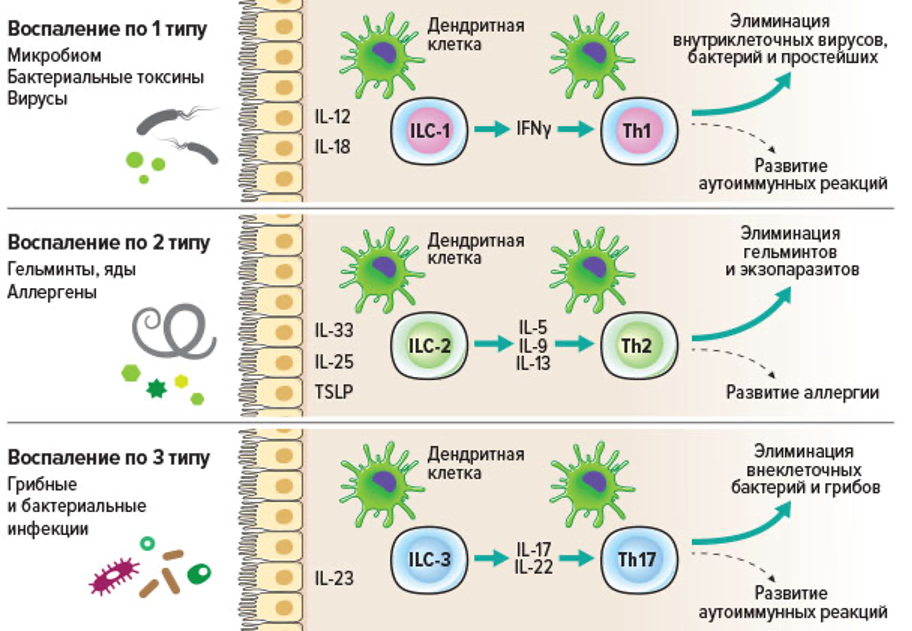
Th1 тип адаптивного иммунитета имеет решающее значение для защиты от внутриклеточных патогенов
Адаптивный иммунный ответ, опосредованный Th1 и цитотоксические CD8+ Т-лимфоцитами, имеет решающее значение для защиты от внутриклеточных патогенов, таких как ротавирусы, норовирусы, Listeria monocytogenes, Citrobacter rodentium, Toxoplasma gondii и Tritrichomonas musculis. Развитие Th1 ответа регулирует популяция сDC1, расположенная в межфолликулярных областях Пейеровых бляшек. Эти интерфолликулярные DCs преимущественно продуцируют IL-12, который индуцирует поляризацию Т-клетки слизистой оболочки в Th1-эффекторы и активацию CD8+ Т-лимфоцитов. Некоторые из межфолликулярных DC также могут мигрировать в дренирующий лимфатический узел и активируют наивные Т-клетки в этом месте, индуцируя системный Th1-ответ против патогена. Локальная продукция IFNg и связывание CD40 могут синергично с сигналами от PRR стимулировать продукцию IL-12. Неконтролируемые Th1-реакции в кишечнике могут приводить к значительным повреждениям собственных тканей и провоцировать развитие Th1-опосредованного колита.
Th2 тип адаптивного ответа эффективен в отношении гельминтов и развивается при аллергических заболеваниях
Th2 тип ответа эффективен в отношении гельминтов и развивается при аллергических заболеваниях. Было обнаружено, что преимущественно cDC2 индуцируют Th2-реакции in vivo и in vitro. В ответ на Nippostrongylus brasiliensis, Trichuris muris и Schistosoma mansoni мыши с дефицитом cDC2 демонстрируют снижение IL-4, IL-5 и IL-13–продуцирующих Th2-клеток в мезентериальных ЛУ и lamina propria кишечника. Th2-клетки, которые продуцируют IL-4, IL-5 и IL–13, индуцируют рекомбинацию переключение продукции IgE-класса антител и эозинофильно-опосредованное воспаление. Тонкий кишечник является основным резервуаром для эозинофилов, которые контролируют активацию cDC2 и Th2 поляризацию. Недавно было установлено, что CD103+CD11b+ cDC2 индуцируют Th2-реакции в тонком кишечнике, тогда как CD103-CD11b+ cDC2 выполняют эту роль в толстой кишке. Кроме того, ILC2, которые продуцируют IL-13, способствуют миграции активированных DCs из легких в ЛУ средостения во время первичной аллергической реакции и индуцируют продукцию хемокина CCL17, привлекающего Th2 и CD103+CD11b+ cDC2. Роль ILC2 в регуляции Th2-ответа в кишечнике не исследована. Ретиноевая кислота подавляет аллергические реакции на пероральные АГ, предотвращая поляризацию Th2-клеток.
Th17 тип адаптивного ответа обеспечивает защиту от внеклеточных патогенов
Th17 тип адаптивного ответа обеспечивает защиту от внеклеточных патогенов, например, грибов Candida albicans или бактерий Salmonella typhimurium, C.rodentium и Yersinia enterocolitica. Поддержание Th17 ответа в кишечнике зависит от сигналов микробиоты, в частности, сегментированных нитевидных бактерий. В исследованиях in vitro было показано, что активированные зрелые DCs GALT направляют поляризацию «наивных» активированных CD4+ Т-клеток преимущественно в сторону Th17. Недавние исследования на мышах показали, что микробиота может оказать влияние на формирование иммунитета в GALT. Например, мыши, выращенные в стерильных условиях, не имеют микробиоты в кишечнике и обладают неразвитой GALT, аномально высоким количество Th2-клеток и аномально низкими уровнями Th1- и Th17-клеток. На энтероцитах у этих животных наблюдается снижение экспрессии TLR, и их DCs не могут формировать трансэпителиальные отростки.
Эффеторные клоны Т- и В-лимфоцитов, сформировавшись в одном индукторном сайте слизистых, могут через кровь мигрировать в любые эффекторные сайты слизистых
Для индукции и дифференцировки клеток Th17 требуется сочетание TGF-b вместе с IL-6 или IL-21, тогда как для экспансии и поддержания Th17 ответа требуется IL-23. Как CD103+CD11b+, так и CD103–CD11b+ cDC2 могут индуцировать поляризацию «наивных» CD4+ Т-клеток в Th17. CD103+CD11b+ cDC2 cDC2 в значительной степени отвечают за дифференцировку и поддержание Th17-клеток в МЛНС и ЛП тонкого кишечника.
В ответ на распознавание антигена Th17 клетки продуцируют IL-17 и IL-22, которые индуцируют секрецию клетками эпителия и нейтрофилами антимикробных субстанций, усиливают барьерные свойства эпителия. Как и в кишечнике, продукция IL-17 очень важна для защиты от бактерий в легких. Преобладающими источниками этого цитокина в NALT/BALT являются легочные Th17-клетки и γδ-Т-клетки, стимулированные IL-23. Th17 в GALT и NALT/BALT также продуцируют IL-22, который в сочетании с IL-17 индуцирует секрецию провоспалительных цитокинов клетками эпителия кишечника и бронхов. Микробиота не только способствует дифференцировке Th17-клеток в GALT, но и может модулировать их активность. Кишечные эпителиальные клетки, в ответ на распознавание определенных компонентов комменсальных микробов, секретируют IL-25, который ингибирует продукцию IL-23 клетками в lamina propria. А без достаточного количества IL-23 пролиферация Th17-клеток блокируется. Эта регуляторная петля обратной отрицательной связи, возможно, эволюционировала, чтобы защитить кишечник от неконтролируемых Th17-реакций, которые могут привести к колиту (тяжелому воспалению кишечника).
Было замечено, что инвазия патогена в одном месте в кишечнике может привести к появлению специфических sIgA не только в кишечнике, но и в дыхательных путях, слюнных, слезных железах, глазной ткани, среднем ухе и даже в лактирующих молочных железах. Точно так же интраназальное введение антигена может привести к обнаружению антигенспецифических sIgA в слюне, миндалинах, трахее, легких и кишечнике. Эти наблюдения привели к появлению концепции, называемой общей иммунной системой слизистой оболочки (или CMIS, от англ. «common mucosal immune system»). Суть этой концепции в том, что эффеторные клоны Т- и В-лимфоцитов, сформировавшись в одном индукторном сайте слизистых (например в ЖКТ), могут через кровь мигрировать в любые эффекторные сайты слизистых, как ВНД, так и ЖКТ. В основе этого явления лежит тот факт, что миграция Т- и В-лимфоцитов из индукторного участка слизистой оболочки в эффекторные участки регулируется общими для всех слизистых рецепторами хоуминга. Эти рецепторы экспрессируют только те Т- и В-клетки, которые были «праймированы» (активированы) в индуктивных сайтах слизистых оболочек, и они отличаются от рецепторов «хоуминга», экспрессируемых Т- и В-клетками, «праймированными» в лимфатических узлах.
Рецепторы «хоуминга» связываются с белками-адрессинами, экспрессируемыми исключительно в эффекторных участках слизистых оболочек. Например, обычная В-клетка, несущая рецептор «хоуминга» α4β1-интегрин, циркулирует и связывается с адрессином VCAM-1, который экспрессируется активированными эндотелиальными клетками в очагах воспаления. В отличие от этого, В-клетки слизистой оболочки экспрессируют α4β7-интегрин, лигандом которого является адгезионная молекула с MAdCAM-1, экспрессируемая только эндотелиальными клетками в слизистой оболочке. Поэтому В-клетки слизистой оболочки игнорируют участки в периферических тканях и, вместо этого, возвращаются в эффекторные участки слизистой оболочки, где молекулы α4β7-интегрина могут связываться с MAdCAM-1. CCR9 связывается с хемокином TECK, секретируемым эпителиальными клетками слизистой оболочки в эффекторных участках. На Т-клетках слизистой оболочки экспрессия α4β7-интегрина, а также хемокинового рецептора CCR9, индуцируются под влиянием DCs в индуктивных участках.
Иммунные реакции, индуцированные в различных участках эффекторов слизистой оболочки, развиваются с разной силой. Наиболее сильные реакции развиваются в тех участках, которые находятся ближе всего к индуктивному участку. Например, если Пейеровы бляшки в GALT являются индуктивным сайтом, сильный антительный ответ будет обнаружен в эффекторных сайтах в близлежащих слизистых оболочках в тонкой кишке (GALT), но в более отдаленных миндалинах (NALT) будет наблюдаться слабый ответ. И, наоборот, иммунный ответ, инициированный в NALT, индуцируют сильные антигенспецифические иммунные реакции в дыхательных путях, но гораздо более слабая реакция будет наблюдаться в кишечнике. Интересно, что появляется все больше доказательств того, что реакция на один патоген в одном индуктивном сайте может влиять на реакцию на совершенно другой патоген в другом индуктивном сайте.
Например, у людей, инфицированных Mycobacterium tuberculosis, патогенной бактерией, вызывающей туберкулез, иммунный ответ в BALT зависит от иммунного ответа в GALT против других патогенов.
В одном исследовании пациентов с инфекциями M.tuberculosis исследователи обнаружили, что у человека, который также страдал от инфекции кишечными гельминтами (которые вызывают в преимущественно Th2 тип иммунного ответа), развивался слабый иммунный ответ против M.tuberculosis. Однако у человека, инфицированного M.tuberculosis и коинфицированного кишечной бактерией Helicobacter pylori (которая вызывает в основном Th1 тип ответа), наблюдался гораздо более сильный ответ против M. tuberculosis.
Различия вариантов ко-инфекции и эффективности CMIS у разных людей могут объяснить тот факт, что во всем мире более 2 миллиардов человек инфицированы M.tuberculosis, но только 20 миллионов человек страдают активным туберкулезом.