GALT образована кишечным эпителием, который обращен в просвет кишки и представляет собой слизистую оболочку I типа, а также лежащей под ним собственно пластинкой lamina propria, состоящей из рыхлой соединительной ткани, расположенной между базальной поверхностью эпителия и мышечным слоем.
Можно выделить три основных компонента кишечного барьера: микробиота, слой слизи; эпителий с его специализированными клетками (бокаловидные клетки, клетки Панета и энтероциты) и клетки лимфоидной ткани, ассоциированные с кишечником, включая интраэпителиальный лимфоциты (рис.86).
В целом кишечный эпителий формирует криптовые (вогнутые) и ворсинчатые (выпуклые) структуры. Исключение составляют небольшие плоские участки кишечного эпителия, называемые фолликул-ассоциированным эпителием (FAE), которые содержат М — клетки и покрывают кишечные фолликулы, межфолликулярные области и купол (dome).
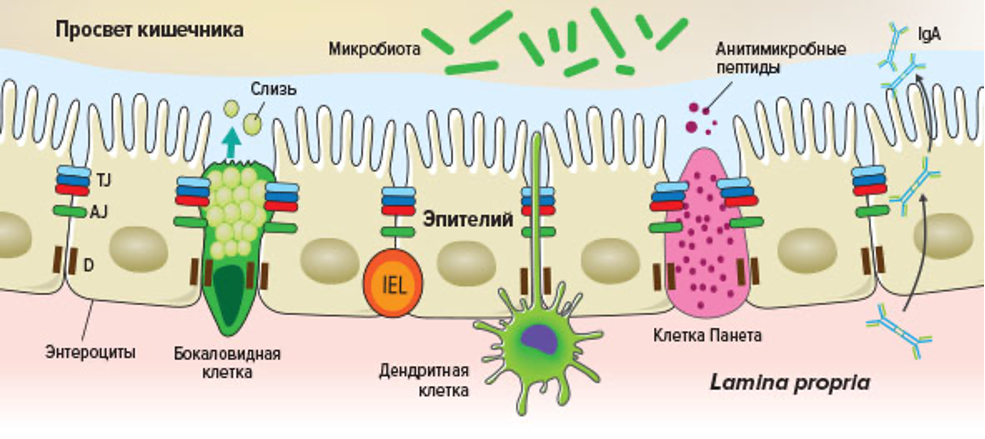
Функция кишечного эпителия состоит как в поглощении нутриентов, так и в защите от патогенов и вредных веществ. Реализация этих взаимно противоположных функций зависит от совместной работы разных типов клеток, формирующих кишечный эпителий. Энтероциты составляют большую часть однослойного эпителия, который выстилает кишечник и образует крипты и ворсинки. Основная функция энтероцитов – поглощение питательных веществ, но исследования последних нескольких лет показали их важную роль в интеграции множества экзогенных и эндогенных сигналов и координации иммунных реакций в GALT. В различных участках слизистой оболочки кишечника между энтероцитами встречаются другие типы эпителиальных клеток.
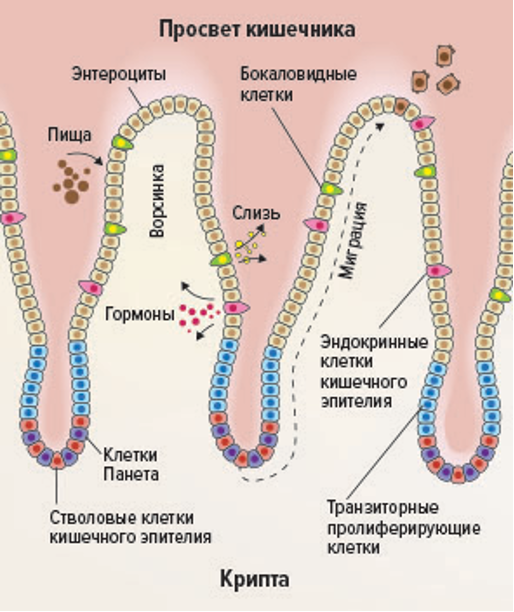
Энтероэндокринные клетки, как правило, локализуются в ворсинках, в то время как клетки Панета и бокаловидные клетки расположены в основании или по бокам кишечных крипт, соответственно. Энтероэндокринные клетки продуцируют слизь и секретируют гормоноподобные молекулы, оказывающие стимулирующее воздействие на окружающие клетки. Клетки Панета продуцируют антимикробные молекулы, а бокаловидные клетки — антимикробные молекулы и слизь (рис.87).
Кроме того, в составе эпителия слизистых ЖКТ и ВДП встречаются ресничные клетки (taft cells) (не показаны на рисунке). Эти, редко встречающиеся секреторные клетки, не вызывали сильного интереса иммунологов, пока в 2016 году не было установлено, что они тесно связаны с развитием 2 типа воспаления в тонком кишечнике.
Ресничные клетки обладают способностью продуцировать широкий спектр участвующих в развитии аллергических реакций биологически активных молекул, таких как IL-25, эйкозаноиды (лейкотриены и простагландин D2) и нейромедиатор ацетилхолин. Внеклеточные сигналы, регулирующие функцию ресничных клеток, плохо изучены.
Апикальная поверхность эпителиоцитов кишечника защищена от патогенов несколькими врожденными барьерами. Прежде всего, любой патоген должен конкурировать за питательные вещества и жизненное пространство с триллионами комменсальных организмов (также называемых микробиотой или микрофлорой), которые обычно живут в кишечном тракте. В дополнение, некоторые из этих комменсалов выделяют токсины, которые могут серьезно ограничивать развитие патогенной микрофлоры. Микробиота также способствует формированию подлежащего слоя слизи. Таким образом, чем больше комменсальных бактерий присутствует в данной области кишечника, тем толще слизь в этой области.
Защитный слой слизи играет решающую роль в поддержании гомеостаза между организмом-хозяина и микробиотой, а также противомикробной защите организма-хозяина. Большая часть слоя кишечной слизи состоит из муцина 2, который образует гидратированный гель толщиной от 300 до 700 мкм.
Слизь продуцируют бокаловидные клетки в нижней части крипты, затем она движется вверх между ворсинками, таким образом, кончики ворсинок не всегда покрыты слизью. В тонком кишечнике слизь образует один прерывистый слой, вероятно, чтобы облегчить всасывание питательных веществ. В желудке и толстой кишке образуются два слоя слизи: наружный «рыхлый» слой, легко смываемый, и внутренний слой слизи, который прочно прикрепляется к эпителию. Большая часть бактерий обнаруживается в наружной части слизи. Таким образом, слой слизи действует как физический барьер, удерживающий местную микробиоту на расстоянии от эпителия. Поэтому бактерии редко вступают в прямой контакт с эпителием тонкого кишечника.
Слизь служит не только механическим барьером для кишечных микробов, она также связывает антимикробные пептиды, которые в большом количестве продуцируются на слизистых разными типами клеток. Практически все антимикробные пептиды в кишечнике происходят из четырех различных источников (рис.88).
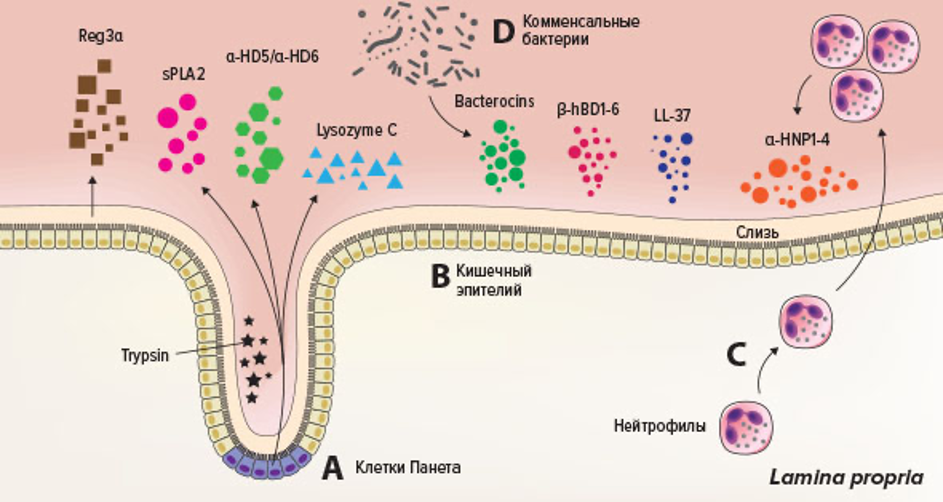
A — клетки Панета: лизоцим, кишечные α-дефензины (pro-HD5 и pro-HD6) и REG3a В — кишечный эпителий: β-дефензины 1-6, LL37, REGa и другие лектины
С – нейтрофилы: значительный запас HNPs D — комменсальные бактерии: широкий спектр антимикробных пептидов бактериального происхождения В — кишечный эпителий: β-дефензины 1-6, LL37, REGa и другие лектины D — комменсальные бактерии: широкий спектр антимикробных пептидов бактериального происхождения
Антимикробные пептиды не диффундируют в просвет кишечника, а остаются прикрепленными к полианионным сульфатированным и сиалированным гликопротеинам муцина слизи. Концентрация антимикробных пептидов в просвете крипты может достигать 100 мг/мл.
Антимикробные пептиды формируют в слое слизи градиент от апикальной поверхности эпителия к просвету кишечника и от дна крипты (где расположены клетки Панета) к вершине ворсинки. В толстой кишке градиент антимикробного пептида усиливается за счет двух слоев слизи. Нижний слой слизи образует физический барьер для проникновения бактерий благодаря своей плотной сетчатой структуре. Он также ограничивает действие антимикробных пептидов в основном на поверхности эпителия.
Если патогену удается выжить в окружении микробиоты и проникнуть через слой слизи, он сталкивается со «щеточной каймой». Это структура образована микроворсинками, которые образуют эпителиоциты. Щеточная кайма покрыта толстым слоем гликокаликса, который несет отрицательный заряд, что отталкивает многие патогенны за счет электрических взаимодействий. Кроме того, с гликокаликсом связаны несколько типов гидролитических ферментов, которые разрушают микробы и макромолекулы. Патоген, которому удается проникнуть через физические и химические барьеры, защищающие слизистую оболочку кишечника, сталкивается с клеточными факторами врожденного иммунитета.
На слизистых, также как и в других компартментах организма, эти рецепторы являются сенсорами «чужого» или эволюционно консервативных структур микробов. Однако особенность иммунитета слизистых состоит в том, что здесь эпителиальные клетки постоянно сталкиваются с комменсальными микробами, поэтому подвергаются постоянному воздействию PAMPs. Большинство кишечных микробов не патогенны, но экспрессируют те же эволюционно консервативные молекулы (PAMPs=MAMPs), что и патогены – ЛПС, петидогликаны, CpG DNA, флагеллин и т.д. Постоянная активация PRR может привести к развитию воспаления и даже спровоцировать аутоиммунные реакции, поэтому в кишечном эпителии выработались механизмы гипореактивности, чтобы ограничить и ослабить сигналы от PRRs. Предотвратить чрезмерную и нежелательную активацию PRRs на слизистых помогает жесткий контроль пространственной локализации и активации.
Эпителиальные клетки экспрессируют мембраносвязанные TLR в основном на своей базолатеральной поверхности. Это гарантирует, что микроорганизмы получают доступ к PRRs только после преодоления физических и химических барьеров, и обеспечивает активацию PRRs только под влиянием потенциально вирулентных патогенов. В гомеостатических условиях большинство рецепторов – TLR2, TLR4 и TLR5 – локализуются на базолатеральной плазматической мембране эпителия в кишечнике и дыхательных путях, или на базальных клетках в стратифицированном эпителии в полости рта. Только после нарушения целостности эпителиального барьера патогенами, активация TLR на базолатеральных поверхностях эндотелиоцитов будет вызывать развитие воспаление.
В условиях воспаления экспрессия TLR2 и TLR4 на эпителиальных клетках может усиливаться. Их внутриклеточная локализация также может изменяться. Так, в дыхательных путях было обнаружено значительное количество TLR4 в комплексе Гольджи, и транслокация этих рецепторов на поверхность клетки происходила только после контакта с патогеном. Например, в клетках молочной железы крупного рогатого скота при воспалении большое количество TLR2 экспрессируется на апикальной стороне эпителиальных клеток молочной железы, тогда как на эпителии здоровой железы наблюдалось низкое количество TLR2. Кроме того, апикальная локализация (транслокация) TLR4 происходит при хроническом воспалении в подвздошной и толстой кишке. Наконец, эндосомальные – локализованные на мембране эндосом клетки – TLR (TLR3, TLR7, TLR8 и TLR9) осуществляют рецепцию лигандов нуклеиновых кислот от вирусов и бактерий, только если патогены проникли в клетку через эндоцитарные или фагоцитарные пути. Кроме того, если патогены или их PAMP попадают в цитоплазму без мембранной упаковки, они могут активировать цитоплазматические рецепторы, такие как NLRs (от англ. «nucleotide-binding and oligomerization domain (NOD)-like receptors») или RIG-I (от англ. «retinoic acid-inducible gene I»).
Повышенный порог чувствительности PRR кишечного эпителия снижает вероятность развития воспаления на кишечную микробиоту.
Ограниченная экспрессия или даже полное отсутствие корецепторов, принимающих участие в сигналинге от PRR, является еще одним механизмом снижения чувствительности системы и повышения порога, необходимого для индукции воспаления. Этот механизм используется для подавления сигналов от TLR2 и TLR4 посредством ограничения взаимодействия рецепторов с их кофакторами CD36, MD2 и CD14 в эпителиальных клетках дыхательных путей. Так, последние из них регулируют активность TLR путем ассоциации с их внеклеточным доменом. Большее количество растворимых форм этих кофакторов могут секретировать резидентные макрофаги при активации и, таким образом, усиливать воспалительную реакцию соседних эпителиальных клеток. Регуляция воспаления также может осуществляться за счет изменения экспрессии негативных регуляторов (или ингибиторов) сигнальных путей от PRR. В настоящее время описано более 200 сигнальных белков, способных подавлять воспаление. Предполагается, что регуляция трансдукции сигнала от PRR осуществляется по-разному в разных типах клеток.
Толстый слой слизи создает градиент микробных продуктов, поступающих к эпителию. Если слой слизи хорошо сформирован, бактериальные продукты поступают к бокаловидным клеткам в низкой концентрации. Если слой слизи тонкий или нарушена его барьерная функция, высокие концентрации микробных молекул достигают поверхности бокаловидных клеток. Это приводит к их активации через TLR и Myd88 с продукцией ROS, и активацией Nlrp6 инфламмасом, опосредованной активацией каспаз 1 и 11, что сопровождается быстрым экзоцитозом гранул, высвобождением слизи, гибелью бокаловидной клетки с последующим ее вытеснением из эпителия.
PRRs играют ключевую роль в поддержании целостности эпителиального барьера и в содействии формированию иммунной системы слизистой оболочки. Комменсальные бактерии через PRRs модулируют экспрессию широкого спектра генов, участвующих в поддержании целостности эпителия, воспалительных реакциях, синтезе и секреции антимикробных пептидов различными клетками. Так, у мышей с дефицитом PRRs может развиться воспаление кишечника. Взаимодействие TLR2 с консервативными структурами микробов в физиологических условиях необходимо для сохранения целостности слизистой оболочки кишечника. Безвредные инкапсулированные бактерии (капсула которых содержит полисахарид А) способны связываться с TLR2. Это индуцирует внутриклеточный сигнал, который усиливает барьерные функции эпителия. В отсутствии устойчивого сигнала от TLR2 межклеточные связи ослабляются, и целостность эпителиального барьера нарушается.
TLR5, TLR9 и NOD2 – три других PRR, важная роль которых для гомеостаза кишечника была недавно раскрыта. Связывание TLR5 с флагеллином комменсальных микробов приводит к усилению экспрессии антиапоптотических генов в энтероцитах, поддерживая их жизнеспособность. TLR9, лигандом которого является CpG (короткая одноцепоченая последовательность ДНК, которая в изобилии представлена в геноме прокариот), выполняет в слизистых функцию, отличную от его роли в качестве эндосомального PRR лейкоцитов врожденного иммунитета. TLR9 экспрессируется преимущественно на базолатеральных поверхностях энтероцитов и клеток Панета. В стационарных условиях взаимодействие TLR9 с CpG комменсальных микробов подавляет воспаление и снижает высвобождение антимикробных пептидов клетками Панета. Цитозольный белок NOD2 (от англ. «nucleotide-binding oligomerization domain containing 2»), лигандом которого является бактериальный мурамил-дипептид, экспрессируется клетками Панета и необходим для продукции этими клетками антимикробных пептидов, нормального развития Пейеровых бляшек и регуляции числа М-клеток.
Большинство интраэпителиальных лимфоцитов проявляют эффекторный фенотип или фенотип клеток-памяти, который определяет их способность быстро реагировать на активирующие сигналы.
Между эпителиальными клетками кишечника на базолатеральной стороне располагаются интраэпителиальные лимфоциты или iIELs (от англ. «intestinal intraepithelial lymphocytes»). Эпителий тонкой кишки содержит ~1 iIEL на каждые 10 эпителиальных клеток, что делает его одним из крупнейших иммунных компартментов организма. Рекрутирование iIELs в кишечный эпителий частично опосредуется хемокином CCL25, который продуцируется кишечным эпителием и распознается рецептором хемокина CCR9 на поверхности iIEL. Проникновение и удержание iIELs в эпителий дополнительно обеспечивается взаимодействием E-кадгерина на энтероцитах с aEb7-интегрином (CD103) на iIELs. В отличие от лимфоцитов в других тканях, iIEL слизистых не проникают в периферические лимфоидные органы. Большинство iIELs проявляют эффекторный фенотип или фенотип клеток-памяти, который определяет их способность быстро реагировать на активирующие сигналы в воспаленных тканях. Как и другие факторы иммунитета, iIELs играют двойственную роль – они необходимы для поддержания барьерной функции кишечного эпителия, но также участвуют в развитии воспаления в желудочно-кишечном тракте.
Интраэпителиальные лимфоциты преимущественно представлены γδ-Т-лимфоцитами.
В норме среди iELs тонкого кишечника примерно 75% составляют CD8-позитивные αβ-Т-клетки, ~10% составляют CD4-позитивные αβ-Т-клетки и 15% составляют клетки, которые являются CD4– и либо CD8–, либо CD8+. Таким образом, iIELs преимущественно представлены Т-лимфоцитами и, по сравнению с большинством других тканей, обогащены Т-клетками, экспрессирующими γδ-TCRs.
Следует напомнить, что в отличие от αβ-Т-клеток, механизм распознавания антигена в γδ-Т-клетках не ограничен распознаванием комплекса антиген-MHC. В то время как αβ-Т-клетки распознают пептидные фрагменты в составе MHC, γδ-Т-клетки могут распознавать молекулы клеточного стресса (MICA и MICB), не пептидные метаболиты биосинтеза изопреноидов, белки теплового шока и так далее. Более того, для γδ+ iIELs характерен сильно ограниченный антиген-распознающий репертуар TcR с самого рождения, в то время как антиген-распознающий репертуар αβ+ iIELs весьма разнообразен у новорожденных мышей и людей. С возрастом репертуар αβ+ iIELs становится в значительной степени ограниченным или «олигоклональным», что, по-видимому, связано с колонизацией кишки определённой микробиотой. Поэтому в настоящее время предполагают, что при физиологических условиях эти рецепторы распознают в основном антигены комменсальной микробиоты. Еще одной интересной особенностью iIELs является то, что многие клетки экспрессируют гомодимерный вариант CD8 – CD8αα, причем, в отсутствии экспрессии CD8αβ. Известно, что CD8αβ функционирует как ко-рецептор Т-клеточного рецептора, усиливая взаимодействие между TcR и комплексом пептид-MHC I. Более того, на невоспаленном эпителии тонкой кишки экспрессируются молекулы BTNL2 (от англ. «Butyrophilin-like protein 2»), которые функционируют как негативный регулятор активации Т-клеток, так как мутации в гене, кодирующем этот белок, повышают риск воспалительных заболеваний кишечника (ВЗК).
В lamina propria слизистых находятся индукторные сайты, в которых происходит захват, презентация антигенов и запуск реакций адаптивного иммунитета.
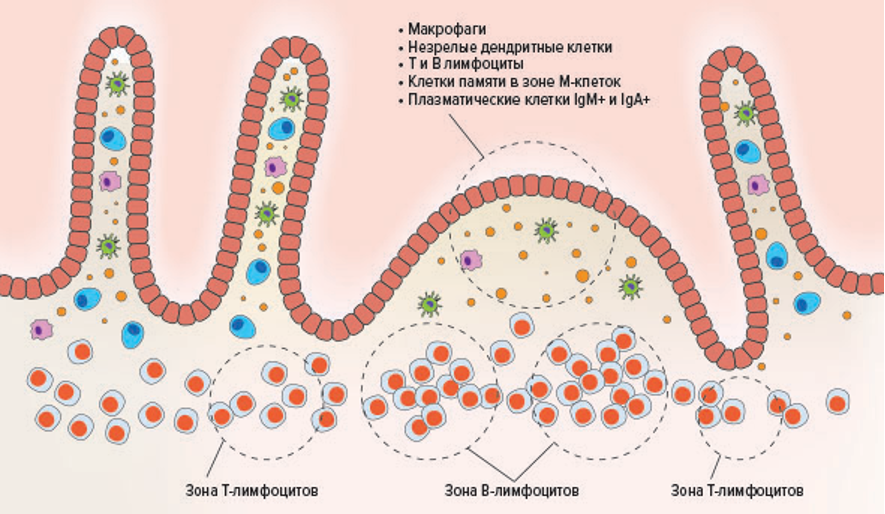
В пределах фолликул-ассоциированного эпителия М-клетки осуществляют захват антигенов из просвета кишечника и их транспорт в lamina propria
Фолликулы в кишечнике лежат непосредственно под небольшими участками плоского кишечного эпителия, который называют фолликул-ассоциированным эпителием или FAE (от англ. «follicle-associated epithelium»). Его основная функция состоит в захвате антигенов из просвета кишечника (Рис.90).

Подавляющее большинство клеток FAE составляют энтероциты, но 10-20% клеток – это большие, не имеющие ресничек клетки, называемые М-клетками (от англ. “membranous” или “microfold”), которые осуществляют перенос или «трансцитоз» (в данном случае, транспорт при помощи эндосом с апикальной поверхности клетки на ее базальную или латеральную без протеолаза) антигенов из просвета кишечника в фолликулы, что позволяет доставить антиген в «нативном» или необработанном виде. М-клетки располагаются над Пейеровыми бляшками. Между фолликулами и вышележащим эпителием находится купол (или англ. «dome»), содержит B- и Т-лимфоциты, DCs и макрофаги. М-клетки участвуют в транспорте интактных микробов или микробных молекул.
Гистологическая структура кишечного фолликула напоминает таковую большинства вторичных лимфоидных органов.
Область между М-клеткой и нижележащими кишечными фолликулами называется куполом (или англ. «dome»). Внутри купола находятся популяции антиген-презентирующих клеток, которые захватывают антигены, транспортируемые М-клеткой. Помимо ДК и макрофагов, купол содержит CD4+ и CD8+ αβ-Т-клетки, покоящиеся В-клетки и различные субпопуляции регуляторных Т-клеток. Сам кишечный фолликул (В-клеточные области) состоит из зародышевого центра, содержащего активированные В-клетки и фолликулярные дендритные клетки. Фолликулы разделены межфолликулярными областями (Т клеточные области), которые содержат большое количество зрелых αβ-Т-клеток, окружающие венулы с высоким эндотелием HEV.
Таким образом, гистологическая структура фолликула напоминает таковую большинства вторичных лимфоидных органов, но в отличие от фолликулов большинства вторичных лимфоидных органов, фолликулы кишечного эпителия лишены афферентных лимфатических сосудов. По сути, функцию афферентного лимфатического сосуда выполняют М-клетки или дендритные клетки и лимфоциты в кишечных фолликулах получают антигены путем их захвата непосредственно с поверхности слизистой. Поэтому М-клетки эволюционировали так, что они лишены компонентов эпителиального барьера, что облегчает интернализацию антигенов.
В пределах GALT выделяют две популяции дендритных клеток cDC1 и cDC2. Как и в других органах и тканях, в lamina propria кишечника обнаруживают cDC1 и cDC2. Как говорилось выше, морфологически Пейеровы бляшки разделены на три основных домена: фолликулярную область, межфолликулярную область и фолликуло-ассоциированный эпителий. Фолликул окружен субэпителиальным куполом, который содержит В-клетки, Т-клетки, макрофаги и DC. cDC1 локализуются в пределах межфолликулярной области, обогащенной Т–клетками, в то время как cDC2 присутствуют под фолликуло-ассоциированным эпителием в субэпителиальном куполе.
Однако презентация захваченных DCs антигенов происходит не только в лимфоидной ткани, ассоциированной с кишечником (или слизистыми оболочками в целом), так как часть этих клеток мигрирует с током лимфы в ближайшие лимфатические узлы, ключевыми из которых являются мезентериальные лимфатические узлы. Так, в совокупности мезентериальные лимфатические узлы, которые дренируют тонкую кишку, слепую кишку и восходящую ободочную кишку, являются самыми крупными лимфоидными скоплениями в организме. Здесь обнаруживаются как мигрирующие с периферии cDC, так и резидентные cDC. Мигрирующие cDC – это MHC-IIhi клетки со зрелым фенотипом, в то время как резидентные cDC – это MHC-II+ клетки с незрелым фенотипом. После активации cDC1 и CD103+ cDC2 тонкой кишки транспортируют люминальные антигены в мезентериальные лимфатические узлы и презентируют эти антигены «наивным» Т-клеткам, что приводит к развитию специфического иммунного ответа уже на уровне организма. В условиях воспаления cDC1 и cDC2 презентируют антигены и индуцируют разные типы адаптивного иммунного ответа, Th1 или Th2, Th17, соответственно (Рис. 91).
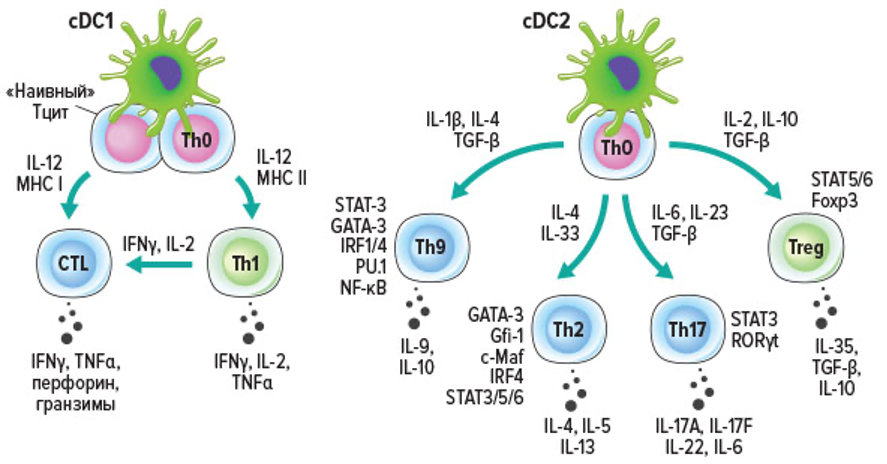
В норме при физиологических условиях большинство DCs в GALT индуцируют анергию или гибель «наивных» активированных Т-лимфоцитов, которые способны распознавать антигены комменсальных микробов или пищевые антигены, либо DCs способствуют их поляризации в регуляторные Т-клетки. Толерогенные свойства DCs формируются под влиянием микроокружения в слизистых. Например, муцин-2 – основной компонент слизи – подавляет активацию cDC под влиянием микробных факторов и способствует индукции оральной толерантности. MLN cDC1 и CD103+ cDC2 экспрессируют avb8-интегрин, который преобразует неактивный TGF-b в его активную форму. Столь же важна роль микробиоты в подавлении иммунного ответа на слизистых оболочках.
Факторы окружающей среды кишечника и микробиоты способствуют формированию cDC с толерогенными свойствами.
Как уже отмечалось ранее, кишечный эпителий находится на переднем крае взаимодействия организма-хозяина как с комменсальными, так и с патогенными микробами. В физиологических условиях взаимодействие PRR энтероцитов с консервативными структурами микробов индуцирует продукцию молекул, которые подавляют развитие воспаления. Адаптивный иммунный ответ на безвредные микробы также предотвращаются. Взаимодействие TLR2 энтероцитов с микробиотой приводит к синтезу этими клетками TGFβ и TSLP, которые способствуют формированию толерогенных DCs, продуцирующих противовоспалительный цитокин IL-10 и индуцирующих дифференцировку iTreg. Продукция энтероцитами TSLP необходима для нормального иммунного гомеостаза кишечника, поскольку этот цитокин подавляет выработку IL-12 зрелыми DCs. Таким образом, в кишечнике любая активированная Т-клетка с большей вероятностью поляризуется в сторону Th2, а не Th1 или Th17, что способствует развитию иммунных реакций, при которых вероятность повреждения кишечного эпителия не высока.
Наиболее хорошо изученным диетическим фактором, определяющим толерогенные свойства DCs кишечника, является метаболит витамина А – ретиноевая кислота (РА). Стромальные клетки кишечника, эпителиальные клетки и DCs обладают способностью превращать витамин А в РА благодаря экспрессии ретинальдегиддегидрогеназы (RALDH). РА оказывает плейотропное действие на иммунную систему кишечника. РA поддерживает определенную функциональную программу, индуцируя как в cDC1, так и в cDC2, экспрессию RALDH и a4b7-интегрина. Продукция РА обеспечивает тропизм лимфоцитов к кишечнику, индуцируя экспрессию интегрина α4β7 и рецептора хемокина CCR9 на этих клетках. Интегрин a4b7 и хемокиновый рецептор CCR9 служат молекулами хоуминга и обеспечивают миграцию клеток в кишку. Кроме того, РA способствует доминированию в кишке cDC2, а не cDC1 популяции.
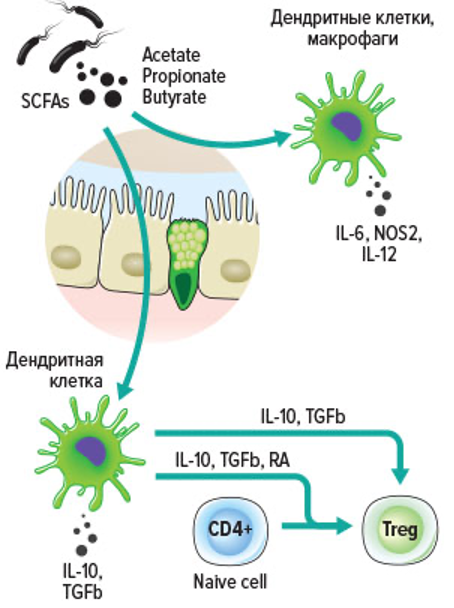
В дополнение к РА, стимулировать экспрессию RALDH в DCs и эпителиальных клетках кишечника способны короткоцепочечные жирные кислоты – бутираты и пропионаты, генерируемые из пищевых волокон (Рис.92). Короткоцепочечные жирные кислоты способствуют индукции экспрессии Foxp3 в активированных «наивных» CD4+ Т-лимфоцитах, что превращает их в iTregs. Это, в свою очередь, увеличивает в кишке количество Treg, тем самым, способствуя развитию оральной толерантности. Индуцированная РA, экспрессия CCR9 на Tregs, наделяет их способностью мигрировать из мезентериальных ЛУ в lamina propria кишечника.
При развитии воспаления из-за травмы или инфекции, в lamina propria привлекаются новые DCs, «не подвергнутые» толерогенным сигналам микроокружения кишечника. Распознавание этими клетками PAMPs/DAMPs приводит к их активации, созреванию и приобретению провоспалительного фенотипа. В этом случае, DCs будут презентировать процессированные антигены и экспрессировать необходимый набор ко-стимуляцонных молекул на своей поверхности для активации Т-клеток слизистой оболочки. Зрелые DCs могут мигрировать из купола Пейровой бляшки в дренирующий мезентериальный лимфатический узел, где будут презентировать антигены, активировать «наивные» Т- лимфоциты с вовлечением в иммунный ответ В-клеток и развитием системных реакций на слизистых.
Метаболиты микробиоты (коротко-цепочечные жирные кислоты: ацетаты, пропионат, бутират) подавляют воспаление, индуцируя продукцию TGF-β.
Под влиянием TGF-β который в изобилии продуцирует микроокружение, макрофаги и DCs приобретают уникальный фенотип, который позволяет продуцировать противоспалительные цитокины и индуцировать дифференцировку в Tregs.
Дифференцировке в Tregs также способствует локальная продукция ретиноевой кислоты CD103+ дендритными клетками и макрофагами, экспрессирующими ретинолдегидрогеназу. Кроме того, короткоцепочечные жирные кислоты подавляют эеспрессию HDAC (Histone deacetylase) и провоспадителные свойства макрофагов и DCs.