Взаимодействие между активированным антигеном В-лимфоцитом и антиген-специфическим фолликулярных Т-хелпером играет ключевую роль в развитии специфического гуморального ответа.
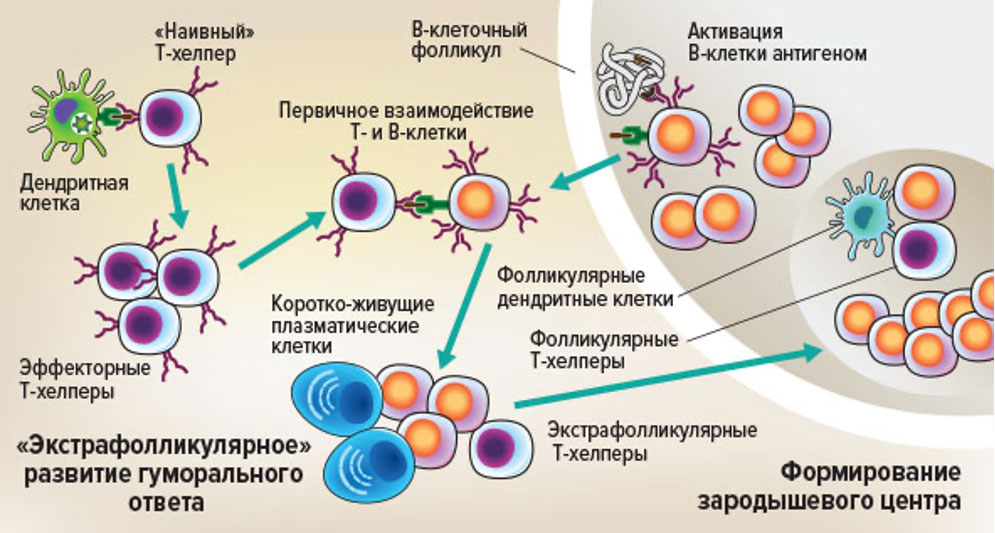
Считается, что взаимодействие В-лимфоцитов с Tfh клеток происходит на границе Т- и В-зависимых зон лимфоидной ткани в периферических лимфоидных органах различной локализации. Однако, еще до специфического взаимодействия этих клеток, должно произойти два ключевых события, которые тесно связаны с процессами распознавания и презентации антигенов (рис.74).

(адаптирована из Cellular and Molecular Immunology by Drs. Abul K. Abbas, Andrew H. H. Lichtman, and Shiv Pillai 9th edition, 2017).
Антиген должен быть доставлен в лимфоидную ткань дендритной клеткой из периферических тканей в Т-зависимые зоны для презентации и активации Tfh (при первичном ответе Tfh формируются впервые за счет поляризующих цитокинов, а при вторичном ответе – ключевую роль в повторном распознавании антигена играют Tfh памяти). Одновременно растворимый антиген должен быть доставлен в лимфоидную ткань с током лимфы и распознан В-клеткой в В-зависимой зоне лимфоидной ткани. В дальнейшем антиген должен быть поглощен при помощи рецептор-опосредованного эндоцитоза, процессирован и презентирован активированным В-лимфоцитом, который в данном случае выполняет роль АПК. В отличие от других профессиональных АПК, В лимфоцит специфически распознает и захватывает антиген с помощью В клеточного рецептора. Следует отметить, что В-клетки распознают своим В-клеточным рецептором «нативные» или не процессированные антигены. Это могут быть части крупных молекул с высокой молекулярной массой или даже части целых вирусов и бактерий (рис.75).
В ходе дальнейшего процессинга эти крупные «конформационные» антигены разделяются на небольшие фрагменты (отдельные эпитопы), которые в фаголизосомах встраиваются в молекулы МНС II класса. Суть этого процесса сводится к тому, что исходно один «антиген», поглощенный и «разрезанный» на отдельные пептидные фрагменты В-клеткой, может быть распознан несколькими Tfh, обладающими различной специфичностью уже к отдельным эпитопам исходно большой молекулы – этот механизм, по-видимому, увеличивает вероятность встречи В- и Т-клеток в пределах лимфоидной ткани. Более того, подобно другим АПК, В-клетка также нуждается в сигнале от паттерн-распознающих рецепторов врожденного иммунитета. Примером такого сигнала может служить взаимодействие CD21 – рецептора на В-лимфоцитах с фрагментами С3 компонента каскада комплемента. Получение этого сигнала подтверждает, что В-клеткой был распознан именно «чужеродный» антиген, и является защитой от потенциальной аутореактивности. Сигналы от рецепторов врожденного иммунитета, индуцируют экспрессию В-лимфоцитом молекул миграции в Т-зависимые зоны (в первую очередь, CCR7).
В Т-зависимой зоне лимфатического узла, при распознавании антигенного пептила происходит активация и клональная экспансия антиген-специфических Tfh, которые начинают двигаться в сторону В-зависимых зон, тогда как в из В-зависимых зон им на встречу устремляются активированные антигеном В-лимфоциты. Считается, что встреча этих клеток происходит как раз на границе Т- и В-зависимых зон периферических лимфоидных органов, и В-клетка презентирует антиген Tfh. В случае распознавания антигена в составе с МНС II класса Т-клеточным рецептором, происходит формирование «иммунного» синапса и обмен сигналами между клетками.
После этого В-лимфоцит перестает выполнять функции АПК, и в нем активируются программы, свойственные лимфоцитам, главной из которых является клональная экспансия. Ключевую роль в данном процессе играют взаимодействие CD40L-CD40 и продукция цитокинов фолликулярным Тh, про что было рассказано ранее. В ходе клональной экспансии и серии последовательных циклов митозов формирование части В-клеток может происходить вне В-клеточного фолликула. Это касается, в частности, формирования клона короткоживущих плазматических клеток, которые секретируют антитела той же специфичности, что и исходный В-лимфоцит; Однако часть активированных В-клеток возвращается в В-зависимые зоны, пролиферирует и формирует В-клеточные фолликулы сложной морфологической структуры и клеточного состава. Именно с формированием В-клеточного фолликула связана дифференцировка В-клеток памяти и плазматических клеток, способных к синтезу и секреции высоко-аффинных антител классов, отличных от IgM. Ключевую роль в формировании фолликула принимают фолликулярные Th, а также специализированные типы дендритных клеток, получивших название фолликулярных дендритных клеток:
Фолликулярные Th обеспечивают В-клетки необходимыми цитокинами и контактными сигнальными молекулами, необходимыми для пролиферации, активации процесса соматических гипермутаций, а также переключения класса синтезируемых антител. Фолликулярные дендритные клетки, в отличие от всех остальных типов ДК, имеют негемопоэтическое происхождение. Они способны сорбировать и длительное время экспонировать на своей поверхности антигены в том виде, в котором они поступили в лимфатический узел с током лимфы. То есть, они являются «хранилищем» неизменных или «нативных» «конформационных» антигенов. Это «хранилище» антигенов необходимо для отбора высокоаффинных клонов В-клеток после соматических гипермутаций В-клеточных антиген-распознающих рецепторов.
Итак, в сформированном В-клеточном фолликуле, в темной зоне, под действием цитокинов Tfh происходит клональная экспансия или пролиферация В-клеток. Пролиферация В клеток сопровождается соматическими гипермутациями, точечные замены нуклеотидов в участках, кодирующих антигенразпознащие сайты В-клеточного рецептора. При этом, фермент AID (от англ. «activation-induced deaminase») случайным образом замещает С на U в пределах CDR участков антигенраспознающих рецепторов. В дальнейшем при репликации ДНК U может заменяться на Т, в свою очередь, С тоже может заменяться на Т. Только В-клетки, которые случайным образом сформировали высоко-аффинный В-клеточный рецептор могут «отнять» антиген у фолликулярной дендритной клетки, процессировать его и презентировать Tfh (рис.76).

(адаптирована из Cellular and Molecular Immunology by Drs. Abul K. Abbas, Andrew H. H. Lichtman, and Shiv Pillai 9th edition, 2017).
Поэтому только В-клетки, несущие высокоаффинный В клеточный рецептор получают сигнал на выживание от Tfh. Таким образом, фолликулярные ДК и Tfh осуществляют селекцию или отбор из, образовавшихся после гипермутаций клонов, несущих высокоаффинный рецептор. Этот процесс напоминает «естественный отбор» в ходе которого сначала формируется разнообразие В лимфоцитов с немного отличающимися рецепторами, а потом из них отбираются «лучшие», с высокоаффинным рецептором. Сигнал на выживание получает В-клетка, способная связать антиген, и так как количество антигена сильно лимитировано, то связывание будет происходить только с самыми высоко-аффинными рецепторами. Остальные В-лимфоциты сигналов на выживание не получат, и будут погибать путем апоптоза. Описанные процессы селекции протекают в светлой зоне фолликула, где содержание клеток снижается на порядки по сравнению с этим в темной зоне (рис.77).

Гуморальный иммунный ответ в большей или меньшей степени развивается при любом типе иммунного ответа, в ответ на проникновение любого патогена. Однако разные типы иммунного ответа отличаются продукцией классов, синтезируемых антител. Переключение класса синтезируемых антител с IgM на IgG, IgA или IgE в В-лимфоцитах происходит под действием Tfh и цитокинового микроокружения, характерного для каждого типа иммунного ответа. Каждый класс антител обладает своими специфическими свойствами. Так IgG способны к опсонизации внеклеточных патогенов для повышения эффективности фагоцитоза макрофагами и нейтрофилами. Эти антитела могут активировать каскад комплемента по классическому пути, что способствует борьбе с внеклеточными патогенами. IgG опосредуют антитело-зависимую клеточную цитотоксичность НК-клеток, направленную на элиминацию вирус-инфицированных и опухолевых клеток. Возможность переноса IgG через плаценту способствует формированию гуморальной защиты новорожденных. Антитела класса IgA обеспечивают мукозальный иммунитет, защиту слизистых оболочек, участвуют в формировании и поддержании состава микрофлоры кишечника. Антитела класса IgE регулируют активность тучных клеток, базофилов и эозинофилов для борьбы с многоклеточными патогенами и грибами (рис.78).

(адаптирована из Cellular and Molecular Immunology by Drs. Abul K. Abbas, Andrew H. H. Lichtman, and Shiv Pillai 9th edition, 2017).