Т-хелперы продуцируют разные комбинации цитокинов и руководят функциями других клеток иммунной системы. Среди всех клеток систем врожденного и приобретенного иммунитета Т-хелперы (Тh) выделяются особенным разнообразием выполняемых функций, что находит свое отражение в крайне высокой гетерогенности данной популяции (табл.40).
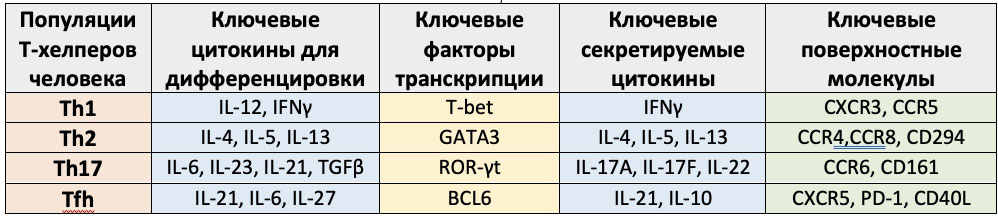
Основные характеристики «поляризованных» Т-хелперов, используемые для выявления отдельных субпопуляций клеток
Однако все эти клетки объединяет общее свойство – они, продуцируя разные комбинации цитокинов, руководят функциями других клеток иммунной системы, или помогают клеткам иммунной системы выполнять их функции. Поэтому они получили название хелперы (рис.71).
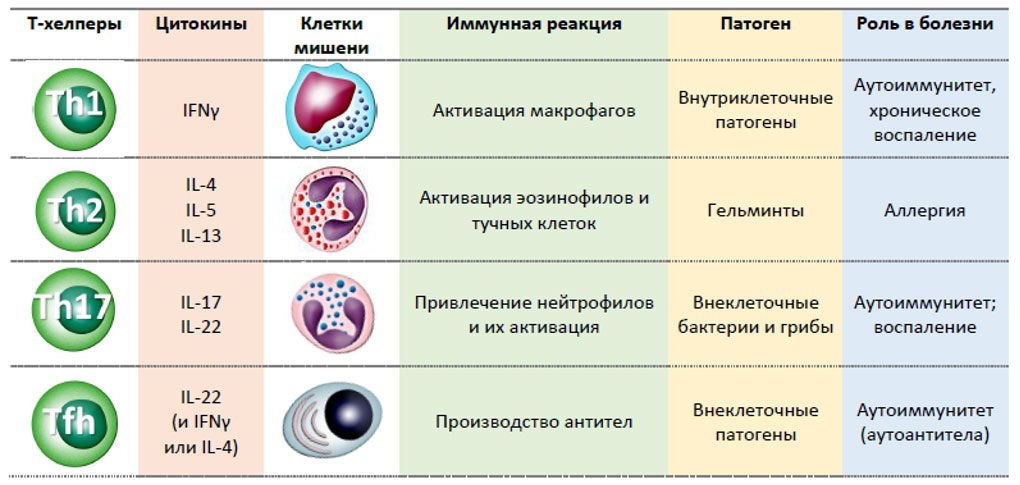
Исходно на основании продукции цитокинов среди CD3+CD4+ лимфоцитов выделяли клетки, способные к синтезу IFNγ и получившие название Т-хелперов 1 типа (Тh1), и клетки, названные Т-хелперами 2 типа (Тh2) и синтезирующие IL-4. Позднее были описаны Th17 и фолликулярные Т-хелперы (Tfh).
Каждый из типов Т хелперов за счет продукции цитокинов поддерживает определенный тип воспаления и адаптивного иммунного ответа. Так, поляризация в сторону Тh1 регулирует макрофагально-лимфоцитарное воспаление, направленное преимущественно на элиминацию внутриклеточных патогенов. Поляризация в сторону Тh2 способствует активации тучных клеток, базофилов и эозинофилов и развивается в ответ инвазию многоклеточными патогенами. Поляризация в сторону Тh17 приводит к активации нейтрофилов, которые играют ключевую роль в уничтожении грибов и внеклеточно-паразитирующих бактерий. И, наконец, Tfh регулируют развитие гуморального иммунного ответа, активацию и дифференцировку В-лимфоцитов и продукцию антител. Мы остановимся только на этих четырех типах клеток, так как их реальное существование не подвергается сомнению большинством исследователей. Следует отметить, что с завидной регулярностью появляются работы, свидетельствующие о возможности перехода Th из одной популяции в другую в зависимости от сигналов микроокружения, цитокиновых сигналов, изменения метаболического профиля и широчайшего спектра других факторов.
Th1 тип адаптивного иммунного ответа
Ключевую роль в «поляризации» Th0 в Th1 играет IL-12, синтезируемый в лимфоидной ткани активированными дендритными клетками, хотя IL-18 и IL-33 в присутствии IL-12 также способствуют появлению CD3+CD4+ клеток со свойствами Th1. Поляризация наивного Т — хелпера в Th1 происходит под контролем транскрипционного фактора T-bet. Для Th1 характерна продукция провоспалительных цитокинов IFNγ и TNFα, а также IL-2 и IL-15, и экспрессия на поверхностной мембране CXCR3, CCR5 и рецептора для IL-18 (IL-18R). Основной задачей Th1 является активация тканевых макрофагов и мигрировавших в периферические ткани моноцитов с целью повышения эффективности уничтожения поглощенных этими клетками патогенов. Основным фактором, обеспечивающим реализацию этих функций, является IFNγ, функции которого будут описаны ниже. При гиперфункции Th1, связанной с продукцией цитокинов (в первую очередь, IFNγ и TNFα), в организме могут формироваться очаги хронического воспаления, вызывающие повреждения окружающих тканей (гранулем). Более того, формирование клонов аутореактивных Th1 связано с развитием органно-специфических и системных аутоиммунных заболеваний.
Th2 тип адаптивного иммунного ответа
Дифференцировка Th0 в Th2 клетки происходит под влиянием IL-4, при условии, что в микроокружении отсутствует IL-12. Поляризацию в сторону Th2 регулирует транскрипционный фактор Gata3. Th2 лимфоциты синтезируют IL-4, IL-5, IL-6, IL-9, IL-10 и IL-13, отвечающие за регуляцию клеточного и гуморального иммунного ответа (функции этих цитокинов будут рассмотрены ниже). Для этих клеток характерна экспрессия на поверхностной мембране CD294, CCR3, CCR4, CCR8. Основной функцией Th2 является активация тканевых тучных клеток и мигрировавших в периферические ткани из крови базофилов и эозинофилов с целью повышения эффективности уничтожения крупных многоклеточных патогенов (в первую очередь, гельминтов) и их ядов.
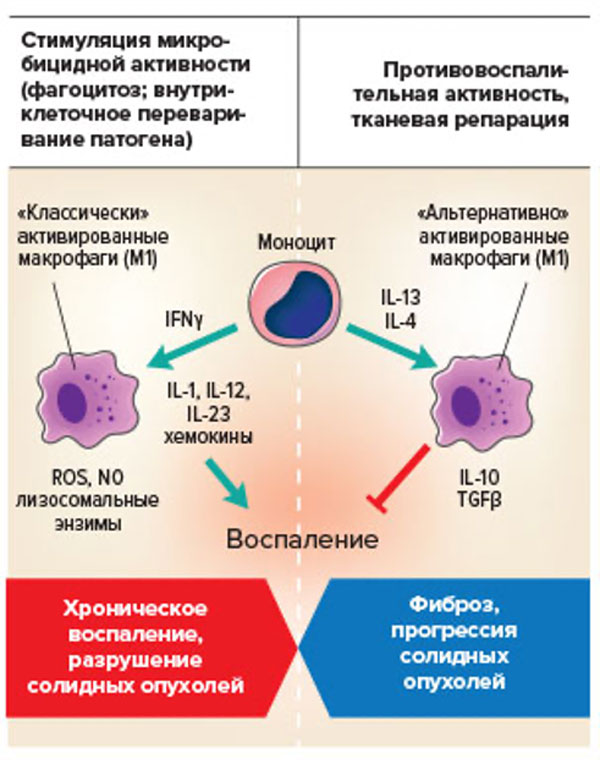
Другой важной функцией Th2 является стимуляция «поляризации» тканевых макрофагов (рис.72) в сторону М2. Это способствует запуску процессов репарации ткани при гельминтозах, а гиперпродукция Th2 цитокинов может сопровождаться формированием очагов фиброза в тканях. Помимо активации лейкоцитов, цитокины, продуцируемые Th2, влияют на функционирование гладкомышечных клеток трубчатых органов, эндотелий сосудов и тканевые макрофаги.
Th17 тип адаптивного иммунного ответа
Тh17 играют ведущую роль в защите от внеклеточных патогенов — бактерий и грибов, являясь ключевыми клетками, которые регулируют развитие воспалительной реакции по 3 типу. Th17 были впервые описаны в 2005 как клетки с фенотипом CD3+CD4+, способные к синтезу и секреции IL-17A, IL-17F, IL-21 и IL-22. Формирование Th17 из «наивных» клеток у мыши и человека происходит под действием таких цитокинов как TGF-β, IL-1β, IL-6, IL-21 и IL-23 и находится пол контролем транскрипционного фактора RORγt. На поверхностной мембране Th17 обнаружена высокая плотность таких антигенов как CXCR4, CCR6 и CD161. Основной задачей Th17 является активация тканевых и мигрировавших в периферические ткани из крови нейтрофилов с целью повышения эффективности уничтожения внеклеточных патогенов за счет фагоцитоза.
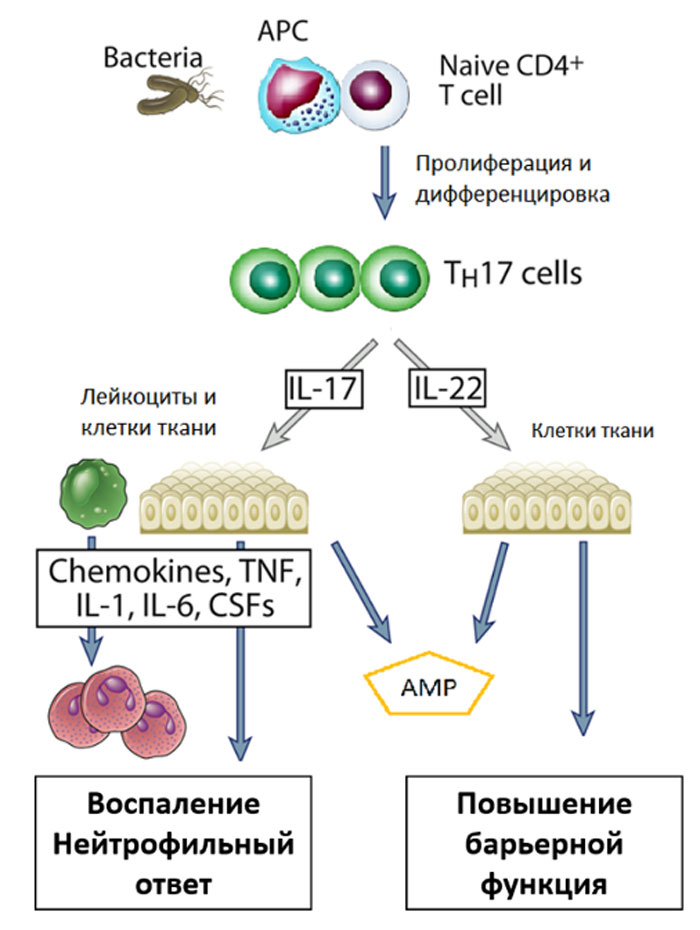
(адаптирована из Cellular and Molecular Immunology by Drs. Abul K. Abbas, Andrew H. H. Lichtman, and Shiv Pillai 9th edition, 2017).
Помимо активации лейкоцитов, цитокины, продуцируемые Th17 повышают барьерные функции эпителиев, активируют эндотелий сосудов, тканевые макрофаги и фибробласты (рис.73). Совместно с Тh1, Тh17 регулируют функциональную активность фагоцитов (нейтрофилов и моноцитов) при реализации клеточно-опосредованных реакций врожденного иммунитета. Гиперактивация Тh17 является причиной развития широкого спектра патологических состояний, в основе которых лежат неконтролируемые воспалительные процессы в различных тканях — псориаз, воспалительное заболевание кишечника, ревматоидный артрит и рассеянный склероз. Именно поэтому Th17 являются мишенью для различных биологических препаратов, направленных на нейтрализацию эффекторных цитокинов (IL-6, IL-17, IL-23, TNFα).
Фолликулярные Т-хелперы
В начале 2000-ых годов впервые в составе миндалин была охарактеризована популяция Т-хелперов, с необычным фенотипом. Эти клетки несли на своей поверхности нехарактерные для Т лимфоцитов хемокиновые рецепторы CXCR5 и CCR7, отвечающие за миграцию в В-клеточные фолликулы. Позже было установлено, что основной их функцией является участие в формировании и развитии специфического гуморального иммунного ответа, поддержании жизнеспособности и пролиферации В-клеток, регуляции переключения класса синтезируемых антител, запуске соматических гипермутаций, а также в дифференцировке В-лимфоцитов в сторону плазматических клеток и долгоживущих В-клеток памяти. Исходя из описанных функций и способности мигрировать в В-клеточные фолликулы, эти Т хелперы получили название Tfh. Экспрессия хемокинового рецептора CXCR5 позволяет Tfh направленно мигрировать в В-зависимые зоны лимфатических узлов по градиенту концентрации хемокина CXCL13, также известного как BCA-1 (от англ. «B cell–attracting chemokine 1»). CXCL13 синтезируется клетками стромы В-клеточных фолликулов в периферических лимфоидных органах, что определяет миграцию В-клеток и фолликулярных Т-хелперов, экспрессирующих CXCR5 в эти области. Ключевыми поверхностными маркерами Tfh, помимо CXCR5 (CD185), являются молекулы CD40L (CD152), ICOS (CD278), SAP и PD-1 (CD279), которые участвуют во взаимодействии Tfh с В-лимфоцитами.
В настоящее время известно, что «поляризацию» Th0 в сторону Tfh регулирует широкий спектр цитокинов (IL-6, IL-21, IL-12, IL-23, IL-2, IL-7,TGFb) и транскрипционных факторов (Bcl-6, STAT1, STAT3, STAT4, Batf, IRF4, с-Maf, TCF-1, Acl2). Секретируемые Tfh цитокины влияют на следующие процессы:
- за счет продукции цитокинов (IL-4 и BAFF) и контактных взаимодействий (CD40L со стороны Т-клетки и CD40 со стороны В-клетки) Tfh блокируют запуск апоптоза в активированной В-клетке;
- при помощи взаимодействия CD40L (со стороны Tfh) и CD40 (со стороны В-клетки) в последней запускается пролиферация;
- IL-21, синтезируемый Tfh, запускает дифференцировку В-клетки в плазматическую клетку;
- под действием цитокинов (IL-4 и IL-21) в В-клетке инициируется процесс соматических гипермутаций, приводящий (после селекции полученных клонов) к увеличению аффинности В-клеточного рецептора и секретируемых антител;
- цитокины, секретируемые Tfh (IL-4, IL-17, IL-21), стимулируют переключение класса синтезируемых В-клеткой антител с IgM на IgG, IgA или IgE.