Иммунный ответ по 2 типу, развитие которого регулируют цитокины Th2 и ILC2, характеризуется вовлечением в воспалительный процесс эозинофилов, тучных клеток, базофилов и альтернативно активированных макрофагов (AAM).
Иммунный ответ по 2 типу, развитие которого регулируют цитокины Th2 и ILC2, характеризуется вовлечением в воспалительный процесс эозинофилов, тучных клеток, базофилов и альтернативно активированных макрофагов (AAM). Этот тип воспаления сформировался в ходе эволюции для защиты от гельминтов, а также от яда змей, насекомых и клещей. Развитие воспалительного процесса по 2 типу в ответ на безвредные антигены, поступающие извне – пища и вдыхаемые аллергены лежит в основе аллергических заболеваний. Распознавание эволюционно-консервативных структур этих патогенов паттернов клетками врожденного иммунитета и тканерезидентными клетками инициирует воспаление 2 типа, но «адаптивные» Th2 – усиливают этот тип ответа за счет продукции цитокинов 2типа – IL-4, -5, -9 и -13 и специфичным, направленным на элиминацию конкретных антигенов (рис.82).
Клетки, принимающие участие в индукции воспаления по 2 типу
Дендритные клетки. Как уже отмечалось ранее, cDC2 обладают фенотипом CD1c+FcεR1+SIRPA+ и играют ведущую роль в инициации Th2 адаптивного ответа. Функции этих клеток пока еще детально не исследованы, но они рассматриваются в качестве одного из источников цитокинов для «поляризации Th0 в сторону Th2, а также обеспечивают необходимые для активации Т-хелперов костимуляционные сигналы.
ILC 2 типа. Было показано, что ILC2 присутствуют в очень небольшом количестве в тканях легких, коже и кишечнике, а также в мезентериальном жире. Эти характеризуются высокой экспрессией фактора транскрипции GATA-3, а также IL-7R, CD25, рецепторов IL-33 и IL-25, ILC2 человека, помимо этих маркеров, также экспрессируют CRTH2 (от англ. «Chemoattractant receptor-homologous molecule expressed on TH2 cells» или CD294) и CD161.
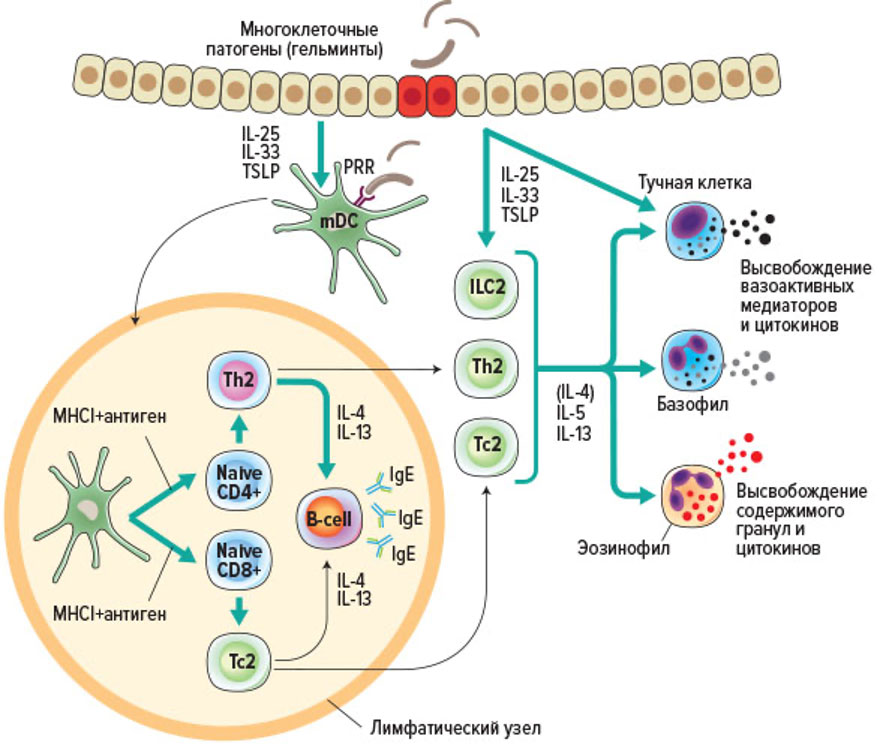
ILC2 происходит под действием IL-25, IL-33 и TSLP, которые продуцируются эпителиальными клетками после повреждения ткани при аллергии или гельминтозах. В ответ на активацию ILC2 человека продуцируют полный набор цитокинов, характерных для Th2 – IL-4, IL-5, IL-9 и IL-13, а также некоторое количество провоспалительных IL-6, IL-8 и GM-CSF. ILC2 являются важнейшим источником IL-5, по крайней мере, у мышей. ILC2 кишечника в ответ на поступление пищи, под действием вазоактивного кишечного пептида конститутивно экспрессируют IL-5 и IL-13. Клинические наблюдения указывают на то, что уровень ILC, продуцирующих IL-13, увеличивается у взрослых с филяриозными инфекциями (например, Loa loa, Wuchereria bancrofti или Onchocerca volvulus). У пациентов, инфицированных Schistosoma haematobium, была обнаружена взаимосвязь между площадью фиброзного поражения тканей и уровнем ILC2. Однако было показано, что у детей в возрасте от 6 до 9 лет количество LC2 положительно коррелируют с успешным разрешением шистосомоза. Лучше всего исследована роль ILC2 при аллергических реакциях, у пациентов с хроническим риносинуситом и бронхиальной астмой. Также ILC2 играют важную роль в процессах регенерации кожи.
Цитокины, принимающие участие в индукции воспаления по 2 типу
Ключевую роль в запуске реакций данного типа играют активированные под влиянием PAMPs клетки барьерных тканей, которые в ответ на стимуляцию и/или повреждение секретируют три ключевые сигнальные молекулы – тимический стромальный лимфопоэтин (TSLP, от англ. «thymic stromal lymphopoietin»), IL-25 и IL-33.
TSLP был впервые охарактеризован как фактор роста лимфоцитов. Основным источником этого цитокина являются активированные эпителиальные клетки легких и кишечника, кератиноциты и фибробласты. Однако дендритные клетки (ДК), тучные клетки и, предположительно, другие иммунные клетки также могут продуцировать TSLP при стимуляции. К числу клеток-мишеней TSLP относят иммунные клетки (дендриты, ILC2, T- и B-клетки, NKT и Treg-клетки, эозинофилы, нейтрофилы, базофилы, моноциты, тучные клетки и макрофаги) и неиммунные клетки (тромбоциты и нейроны). TSLP обладает способностью усиливать активацию и функциональную активность CD11c+ сDC, вызывая усиление экспрессии MHC II, ко-стимулирующих молекул CD40 и CD80 и высвобождение хемокинов, привлекающих клетки Th2. В Т-лимфоцитах TSLP активирует транскрипционный фактор STAT5, что в сочетании с сигналом от Т-клеточного рецептора индуцирует пролиферацию клеток. TSLP участвует в патогенезе различных аллергических заболеваниях (например, атопическом дерматите, бронхиальной астме, эозинофильном эзофагите), хотя показана его роль и в развитии хронических воспалительных (например, хроническая обструктивная болезнь легких и целиакия) и аутоиммунных (например, псориаз, ревматоидный артрит) расстройствах и некоторых видах рака.
IL-33 относится к «внутриядерным» цитокинам, которые высвобождаются после гибели клетки при повреждении тканей. Следует отметить, что IL-33 конститутивно обнаруживается в ядрах эндотелиальных клеток человека, эпителиальных клетках, кератиноцитах, фибробластах, гладкомышечных клетках и глиальных клетках. В живых клетках после синтеза белка, цитозольный IL-33 перемещается в ядро, где связывается с хроматином. N-концевой домен IL-33 содержит последовательность ядерной локализации и хроматин-связывающий домен, что обеспечивает его ядерную транслокацию. Пассивное высвобождение IL-33 из некротических клеток позволяет рассматривать данный цитокин в качества «алармина». Первоначально IL-33 был идентифицирован как индуктор дифференцировки Th2-клеток и продукции цитокинов 2-го типа – IL-4, IL-5 и IL-13. Однако мишенями этого цитокина также являются Th2, ILC2, Treg, NKT-клетки, CD8 + Т-клетки, M2 макрофаги, нейтрофилы, эозинофилы, базофилы, тучные клетки и NK-клетки. IL-33 стимулирует ILC2 для экспрессии цитокинов 2 типа – IL-5 и IL-13, а также эпидермального фактора роста амфирегулина (AREG), чем обусловлено его регенеративное действие при повреждении тканей.
IL-25 относится к семейству цитокинов IL-17. IL-25 вырабатывается многими типами клеток. Эти клетки включают Т-клетки, дендритные клетки, макрофаги, тучные клетки, базофилы, эозинофилы, эпителиальные клетки и клетки Панета. IL-25 стимулирует эффекторные функции эозинофилов и, по-видимому, играет важную роль в Th2-опосредованной активации при глистных инвазиях. Уровень этого цитокина нарастает при обострении аллергических заболеваний дыхательных путей. Основными мишенями IL-25 являются клетки врожденного иммунитета – NKT-клетки, моноциты и ILC2. IL-25 способствует поляризации «наивных» CD4+ Т-лимфоцитов в сторону Th2, а усиливает продукцию цитокинов эффекторными Th2 клетками и Th2 клетки памяти. Гиперпродукция IL-25 может способствовать нарушению регуляции Th2-ответа при астме, снижать эффективность защитного иммунитета против гельминтов, а также приводить к развитию некоторых аутоиммунных заболеваний.
Эффекторные клетки приобретенного иммунитета воспалительных реакций 2 типа
CD4+ Th2 клетки
IL-2 и IL-4 являются двумя ключевыми цитокинами для «поляризации» Th2, Эт а комбинация цитокинов индуцирует экспрессию фактора транскрипции GATA3, абсолютно необходимого для дифференцировки клеток Th2 и их функционирования как in vitro, так и in vivo. Более того, GATA3 не только играет важную роль в индукции и поддержании программы Th2 клеток, он также подавляет экспрессию других факторов транскрипции – T-bet и RORγt. Помимо GATA3, другие факторы транскрипции, включая c-Maf, STAT3 и Notch/CSL, также могут регулировать дифференцировку и функции Th2-клеток. Было обнаружено, что присутствие IL-4 в микроокружении при взаимодействии АПК с «наивными» Th0-клетками критически необходимо для дифференцировки Th2-клеток как у мышей, так и у человека, но источник этого цитокина до сих пор не известен. Предполагают, что базофилы могут действовать как Th2-индуцирующие АПК, но только для Т клеток памяти. Потому что только зрелые ДК имеют достаточно высокий для активации наивных Т клеток уровень костимуляторных сигналов. Каким бы ни был источник раннего IL-4, этот цитокин имеет решающее значение для поляризации Th0 в Th2. Th2 человека экспрессируют экспрессируют такой же набор хемокиновых рецепторов, что и ILCs2 — CCR3, CCR4 и CCR8 и мигрируют в ответ на общие сними хемоаттрактанты.
Ключевые эффекторные цитокины и их функции при реализации воспаления по 2 типу
IL-4 и и его биологические эффекты
IL-4 имеет решающее значение для «поляризации» Th0 в сторону Th2 (блокируя другие программы «поляризации» Th и, в первую очередь, Th1), а также является важнейшим аутокринным фактором для дифференцировки и пролиферации Th2. Вместе с тем, IL-4 может также стимулировать DCs и макрофаги к усилению синтеза ими IL-12, обеспечивая механизм отрицательной обратной связи для регуляции Th2 ответа и воспаления по 2 типу в целом. IL-4 стимулирует рост и дифференцировку B-лимфоцитов, стимулирует повышенную экспрессию MHC II и FcRII (CD23) и самое важное, способствует переключению класса синтезируемых антител B-клеток на IgG4 и IgE, который необходим для эффективного противогельминтного иммунитета.
В очаге воспаления IL-4, совместно с IL-13, отвечает за поляризацию и поддержание функциональной активности М2 макрофагов с выраженными противовоспалительными свойствами и способностью запускать процессы репарации и регенерации поврежденных тканей. IL-4 ингибирует секрецию провоспалительных хемокинов и цитокинов, снижает способность производить активные формы кислорода и азота, а также блокирует IFNγ-индуцированную экспрессию молекул клеточной адгезии активированными макрофагами.
IL-4 является важнейшим фактором роста тучных клеток и контролирует IgE-опосредованную дегрануляцию тучных клеток. Продукция IgE позволяет клеткам, несущим рецепторы для IgE, проявлять свои эффекторные свойства. IL-4, IL-5 и IL-13, за счет активации эндотелия сосудов микроциркуляторного русла и секреции хемокинов, отвечают за привлечение лейкоцитов в очаг воспаления. IL-4 стимулирует перистальтику кишечника.
IL-5 и и его биологические эффекты
IL-5 играет ключевую роль во всех аспектах функционирования эозинофилов, включая их активацию, терминальную дифференцировку, пролиферацию и выживании эозинофилов как на ранних стадиях развития, так и в очаге воспаления. Эозинофилы обладают высокой экспрессией рецептора для данного цитокина, а также являются одним из важнейших его источников. IL-5 также подавляет апоптоз активированных эозинофилов. Уровень IL-5 увеличиваются при астме, аллергии и воспалении. IL-5 является важнейшей терапевтической мишенью для заболеваний, связанных с эозинофилами.
IL-13 и его биологические эффекты
IL-13 выполняет множество различных функций как на местного, так и на системного характера. К местным эффектам данного цитокина можно отнести усиление продукции фибробластами коллагена, что является неотъемлемой частью как репаративных процессов, так и фиброзирования тканей. IL-13 стимулирует пролиферацию гладкомышечных клеток и активирует эндотелий сосудов и эпителий слизистых. IL-13 играет важную роль в усилении функциональной активности тучных клеток соединительной ткани и эозинофилов, подавляя провоспалительные свойства тканевых макрофагов, их способствует поляризации в М2. На системном уровне IL-13 усиливает перистальтику кишечника и секрецию слизи способствуя механическому удалению многоклеточных паразитов. IL-13 индуцирует переключение класса синтезируемых В-клеткой антител с IgM на IgE. В целом, функции IL-13 очень тесно схожи с таковыми IL-4, что указывает на синергизм в биологических эффектах этих двух цитокинов.
Воспаление по 2 типу – эффекторная фаза ответа
Длительное время развитие реакций воспаления по 2 типу рассматривали, как процессы направленные на исключительно на уничтожение гельминтов. Сейчас же эти представления существенно расширились, т.к. было установлено, что развитие 2 типа воспаления происходит в ответ на ядовитые ксенобиотики, яды различных эктопаразитов (включая клещей и комаров), гематофагиальной жидкости и ряда других факторов, проникающих в организм из окружающей среды, вызывающих развитие аллергических реакций. Ранее аллергический ответ считался неадекватным проявлением реакций иммунитета, т.к. считалось, что аллергия возникает, в ответ на безвредные антигены окружающей среды. Самая последняя свежая и новая точка зрения состоит в том, что аллергены на самом деле не являются безобидными. Эта гипотеза согласуется с недавней демонстрацией того, что фосфолипаза А2, основной аллерген пчелиного яда, вызывает некроз клеток посредством ферментативного расщепления мембранных фосфолипидов и высвобождения IL-33 инициирует развитие воспаления 2 типа.