Врожденные лимфоидные клетки (ILC) — система клеток врожденного иммунитета (отсутствует антиген-специфические рецепторы), которые происходят от общего лимфоидного предшественника (CLP) и принадлежат к лимфоидной линии. На основании путей развития, фенотипа и продуцируемых сигнальных молекулах, ILC разделены на 5 групп: NK-клетки, ILC1, ILC2, ILC3 и LTi (рис.53). Помимо эффекторной функции ILC участвуют во многих других физиологических функциях, включая гомеостаз ткани, морфогенез, метаболизм, репарацию и регенерацию.
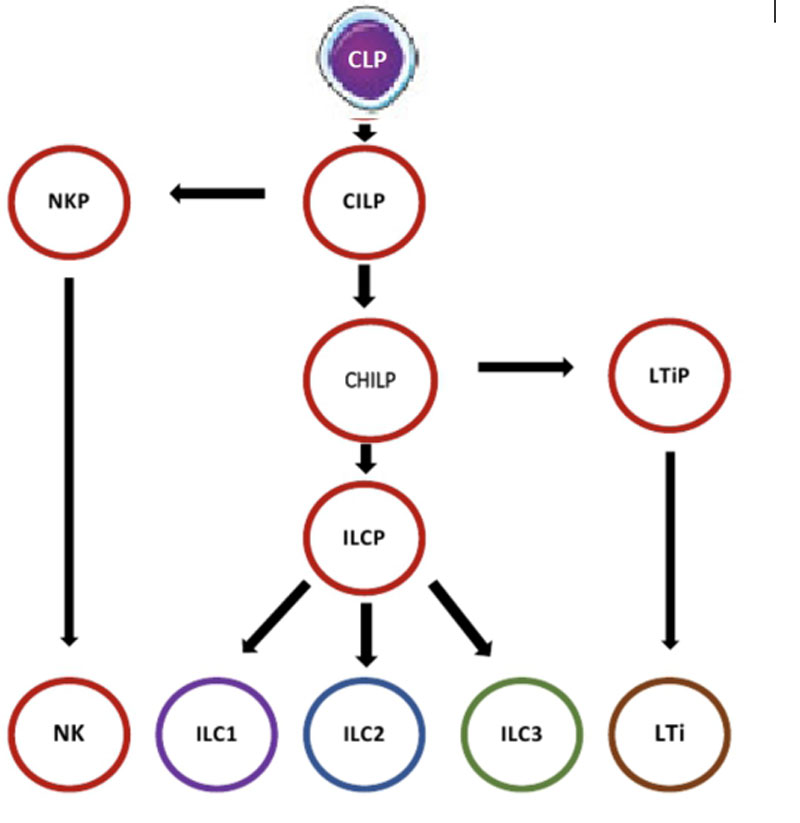
Многие из их функций аналогичны Т-клеткам, поэтому предполагается, что они являются врожденными аналогами Т-клеток. Нарушение регуляции ILC может привести к иммунной патологии. ILC1 и NK-клетки имеют много общих маркеров и функций, однако основная отличительная черта то, что в ткани LC1 это нецитотоксические или слабоцитотоксические клетки, реагирующие инфекций, вызываемых вирусами и некоторыми бактериями. Однако основными клетками этой группы лимфоцитов являются NК-клекти.
Естественные или натуральные киллеры (NK).
Основное свойство, обусловившее название этих клеток, состоит в том, что они способны лизировать определенные клетки-мишени без предварительного контакта и развития реакции типа иммунного ответа. Свойства естественных киллеров могут проявлять Т- и В-лимфоциты, а также макрофаги. Однако лишь NK-клетки представляют собой специализированные естественные киллеры.

Они идентифицируются морфологически как большие гранулярные лимфоциты. По размеру они соответствуют большим лимфоцитам (12—15 мкм в диаметре). Гранулы больших гранулярных лимфоцитов содержат перфорин, гранзимы и хондроитинсульфат А, защищающий NK-клетки от аутолиза.
Число NK в крови — 5-15%; в лимфоузлах и селезенке 2,5-5% (от всех мононуклеаров). Срок жизни – 7-10 суток (IL-15). Т- клеточный рецептор отсутствует. В тимусе не «обучаются», созревают в лимфатических узлах. Популяция не клонируется.
Рецептор NK-клеток, предназначенный для распознавания клеток-мишеней, представляет собой С-лектин, т. е. белок, распознающий углеводные остатки при участии ионов Са2+. Он распознает концевые остатки маннозы на молекулах мембранных гликопротеинов и гликолипидов. В норме эти остатки на большинстве клеток, с которыми контактируют зрелые лимфоциты и макрофаги, блокированы остатками сиаловой кислоты. Это защищает их от фагоцитоза макрофагами, которые тоже имеют рецепторы, связывающие маннозу, и от лизиса NK-клетками. Свободная манноза присутствует на поверхности юных и, наоборот, старых клеток, а также пролиферирующих и трансформированных (инфицированных вирусами и злокачественно перерожденных) клеток. Однако NК-клетки способны убивать клетки лишь небольшого числа опухолевых линий.
Природа подавления активности естественных киллеров в основном прояснилась в результате открытия рецепторов, ограничивающих киллинг (KIR). Эти рецепторы распознают аутологичные молекулы МНС, экспрессированные на клетках-мишенях, и подают в NK-клетку сигнал, который запрещает развитие дальнейших событий, ведущих к цитолизу. В результате мишенями естественных киллеров могут стать клетки, на поверхности которых присутствуют гликоконъюгаты со свободными остатками маннозы и не содержатся молекулы МНС I класса. Большую роль в ограничении активности NK-клеток играют молекулы HLA-C и HLA-B, распознаваемые соответственно KIR-рецепторами.
NK-клетки также секретируют некоторые иммунорегуляторные цитокины (ИФН-γ, ФНО-α, ГМ-КСФ), чем вносят вклад в осуществление специфических форм иммунного ответа.
Мишени – вирус-трансформированные и опухолевые клетки. Распознают «чужое» по отсутствию «своего» – ключевая роль принадлежит активирующим и ингибирующим сигналам:
— считается, что основными лигандами активирующих рецепторов являются молекулы, которые появляются на поверхности собственных клеток организма при различных «стрессовых» ситуациях и инфицировании различными патогенами;
— ингибиторные рецепторы – KIRs (иммуноглобулиновое суперсемейство) и гетеродимер NKG2A (лектиновый рецептор) CD94. Их лигандами являются молекулы МНС I класса: KIRs связываются с HLA-A, -B или -C, тогда как лигандом NKG2/CD94 является HLA-Е. В норме, эти молекулы представлены постоянно на поверхности нормальных, неизмененных клеток. Распознавание происходит следующим образом:
— Активирующие рецепторы, связываясь с собственными лигандами на поверхности клетки, формируют активирующий сигнал.
— Ингибиторные рецепторы, связываясь с молекулами MHC I, плотность экспрессии которых на собственных «неизмененных» клетках организма всегда высока, индуцируют ингибиторный сигнал, подавляя активацию NK. В случае снижения уровня экспрессии молекул МНС I класса на клетках-мишенях, NК-клетки на получают достаточно эффективного ингибирующего сигнала, что приводит в активации NК-клетки.
— Fс-рецепторы (CD16) представлены на поверхности NК-клеток. Они способны распознавать молекулы антител, связавшиеся со своими лигандами на поверхности клеток. Fс-рецепторы обладают ITAM-последовательностью и способны активировать NК-клетки после связывания с молекулами антител.
— Эффекторные функции NK-клеток регулируются комплексом сигналов, полученных как от стимулирующих, так и от ингибирующих рецепторов.
В настоящее время описано три способа индукции апоптоза цитотоксическими клетками в клетках-мишенях:
— во-первых, это цитолиз, осуществляемый за счет высвобождения перфорина, способного к полимеризации в плоскости мембраны клетки-мишени. Данный процесс приводит к образованию каналов для проникновения к клетке гранзимов и гранулизинов, запускающих апоптоз по каспаза-зависимому и/или каспаза-независимому пути;
— во-вторых, это запуск апоптоза в клетке-мишени за счет активации на ее поверхности рецепторов, принадлежащих к семейству TNF-подобных белков;
— в-третьих, индукция апоптоза в клетках-мишенях при помощи растворимых молекул семейства TNF, которые способны вызывать кластеризацию рецепторов и активацию каскада каспаз внутри клеток-мишеней.
Контактный цитолиз происходит в четыре этапа:
Первый этап представляет собой распознавание клеток-мишеней эффекторной клеткой. В случае позвоночных животных ключевую роль в процессах распознавания клеток-мишеней играют молекулы главного комплекса гистосовместимости I класса (MHC).
Второй этап контактного цитолиза, сопровождается формированием контакта (или иммунологического синапса) между клеткой-эффектором и клеткой-мишенью, что приводит к поляризации киллерной клетки. Ключевую роль в этих процессах играют интегриновые рецепторы. При этом движение гранул, содержащих перфорин и гранзимы, в зону контакта направляют микротрубочки, ориентированные в сторону клетки-мишени. Сокращение актиновых волокон приводит к выбросу гранул в зону контакта.
Третий этап – это экзоцитоз или выброс гранул клеткой-эффектором. В состав гранул цитотоксических клеток входит несколько компонентов, ключевыми являются перфорин и гранзим В.
И, наконец, последним – четвертым этапом контактного цитолиза является индукция апоптоза клетки-мишени при помощи описанных ниже механизмов.
Основная характеристика ключевых молекул, принимающих участие в реакциях контактного цитолиз является перфорин, гранзимы и гранзулимы.
Перфорин относится к семейству белков MACPF (от англ. «membrane attack complex and perforin»), к которому также принадлежат белки мембран-атакующего комплекса – компоненты каскада комплемента С6, С7, С8 и С9. Функция — формирования пор в мембране клетки-мишени (процесс является Ca2+-зависимым).
Изменение конформационной структуры перфорина сопровождается появлением на его поверхности гидрофобного участка, обладающего сродством к фосфотидилхолину плазматической мембраны.
Перфорин встраивается в состав мембраны только в форме мономера, однако в окружении гидрофобных частей фосфолипидов он обретает способность к полимеризации. В состав такого комплекса может входить до 20 молекул перфорина, при этом диаметр сформированного канала может достигать 15-20 нм, что вполне достаточно для проникновения в клетку не только различных ионов и молекул воды, но и высокомолекулярных белковых молекул.
Гранзимы — семейство белков, являющихся сериновыми протеазами. В гранулах цитотоксических Т-лимфоцитов и NK-клеток это семейство представлено гранзимами А и В. Гранзимы В способны расщеплять белки, обогащенные остатками кислых аминокислот, в особенности, остатками аспарагиновой кислоты. Кроме того, данная группа белков запускает апоптоз по каспаза-зависимому пути, при этом используются два механизма активации каспаз.
Во-первых, одной из основных мишеней гранзимов В является каспаза-3, взаимодействие с которой сопровождается ее активацией и запуском апоптоза. Во-вторых, гранзимы В способны нарушать целостность наружной мембраны митохондрий и активировать белок Bid, входящий в состав семейства bcl-2. Все это приводит к запуску митохондриального механизма развития апоптоза в клетке-мишени. Активация Bid сопровождается выходом в цитоплазму цитохрома С и других проапоптогенных белков, отвечающих за запуск каскадов реакций, приводящих к гибели клетки-мишени.
Гранулизины относятся к семейству сапонин-подобных белков. Эти низкомолекулярные белки (около 9 кДа) способны проникать через поры, образованные перфорином, и взаимодействовать с липидами митохондрий, что приводит к нарушению целостности и высвобождению в цитоплазму проапоптотических факторов, кроме того, гранулизины способны напрямую активировать каспазу-3. Следует отметить, что все эффекты гранулизинов в настоящее время еще не изучены.
Запуск апоптоза в клетке-мишени осуществляется также за счет активации на ее поверхности рецепторов, принадлежащих к семейству TNF-подобных белков, пар молекул TRAIL — DR4, DR5, FASL – FAS и TNF – TNFRI. Эти рецепторы в цитоплазматической части содержат домен смерти DD (Death Domain), активация которого и запуск апоптотического сигнала происходят при тримеризации рецептора, вызываемой связыванием лигандов. Тримеризация рецепторов и их внутриклеточных DD придаёт последним способность образовывать «сигнальные комплексы», которые приобретают сродство к некоторым инициаторным прокаспазам, обычно прокаспазе 8, которая может активировать каспазу 3 и запустить апоптоз.
NК-клетки синтезируют такие цитокины как IFNγ, TNFα, GM-CSF, IL-10 или IL -13. IFNγ ингибирует пролиферацию опухолевых клеток in vitro и косвенно рост опухоли in vivo путем индукции антиангиогенных факторов; IFNγ усиливает цитотоксичность NK-клеток за счет избыточной экспрессии молекул адгезии и повышения чувствительности опухолевых клеток к цитотоксичности, обусловленной высвобождением гранул или TNF.
ILC 1 типа.
ILC 1 не могут самостоятельно распознавать патогенные паттерны. Эти клетки активируются под влиянием цитокинов микроокружения, которые генерируют DCs и другие тканерезидентные клетки. В ответ на стимуляцию IL-12 и IL-18 ILC1 способны продуцировать IFNγ, TNF, GM-CSF и даже IL-2. Это, а также, экспрессия соответствующих транскрипционного фактора Tbet, позволяет считать эти клетки аналогами Th1 лимфоцитов системы приобретенного иммунитета. Наиболее известными и хорошо изученными представителями ILC 1 являются NK-клетки. В отличие от ILC1 NK-клетки, кроме T-bet+, дополнительно экспрессируют транскрипционный фактор Eomes. Фенотипически ILC1 можно описать как Lin−CD127+ лимфоциты.
ILC 2 типа.
Было показано, что ILC2 присутствуют в очень небольшом количестве в тканях легких, коже и кишечнике, а также в мезентериальном жире. Эти характеризуются высокой экспрессией фактора транскрипции GATA-3, а также IL-7R, CD25, рецепторов IL-33 и IL-25, ILC2 человека, помимо этих маркеров, также экспрессируют CRTH2 (от англ. «Chemoattractant receptor-homologous molecule expressed on TH2 cells» или CD294) и CD161. Активация ILC2 происходит под действием IL-25, IL-33 и TSLP, которые продуцируются эпителиальными клетками после повреждения ткани при аллергии или гельминтозах. В ответ на активацию ILC2 человека продуцируют полный набор цитокинов, характерных для Th2 – IL-4, IL-5, IL-9 и IL-13, а также некоторое количество провоспалительных IL-6, IL-8 и GM-CSF. ILC2 являются важнейшим источником IL-5, по крайней мере, у мышей. ILC2 кишечника в ответ на поступление пищи, под действием вазоактивного кишечного пептида конститутивно экспрессируют IL-5 и IL-13. Клинические наблюдения указывают на то, что уровень ILC, продуцирующих IL-13, увеличивается у взрослых с филяриозными инфекциями (например, Loa loa, Wuchereria bancrofti или Onchocerca volvulus). У пациентов, инфицированных Schistosoma haematobium, была обнаружена взаимосвязь между площадью фиброзного поражения тканей и уровнем ILC2. Однако было показано, что у детей в возрасте от 6 до 9 лет количество LC2 положительно коррелируют с успешным разрешением шистосомоза. Лучше всего исследована роль ILC2 при аллергических реакциях, у пациентов с хроническим риносинуситом и бронхиальной астмой. Также ILC2 играют важную роль в процессах регенерации кожи.
ILC 3 типа.
ILC 3 группы или ILC3 характеризуются экспрессией фактора транскрипции RORγt, который играет ключевую роль в регуляции экспрессии эффекторных молекул этих клеток, а также важен для их развития и эффективного функционирования при активации. Кроме того, они несут на своей поверхности IL-7R, способны к синтезу и секреции IL-17 и IL-22. RORγt+ ILC3, появляющиеся во врем эмбриогенеза важны для пренатального формирования периферических лимфоидных органов – лимфатических узлов и Пейеровских бляшек. RORγt+ ILC3 присутствуют в небольшом количестве и после рождения у людей и мышей на поверхности слизистых оболочек. ILC3 человека характеризуются экспрессией RORγt, IL-7R, LTα1β2 и IL-22 (и в меньшей степени IL-17). Было показано, что в дополнение к упомянутым цитокинам, ILC3 человека, выделенные из миндалин, экспрессируют IL-26, GM-CSF, TNF, CCL20 и IL-2. Продукция цитокинов ILC3 мыши и человека может быть вызвана при стимуляции IL-1β и IL-23.
Клетки iNKT представляют собой липид-чувствительные Т-клетки врожденного иммунитета, напоминающие клетки ILC1 и ILC3, которые мы опишем ниже. Они играют значительную роль в надзоре за опухолью и контроле некоторых вирусных и бактериальных инфекций.
Клетки MAIT очень распространены у людей и проявляют функции аналогичные для клеток iNKT. MAIT-клетки помимо слизистых оболочек могут быть в крови, печени и легких. Клетки MAIT реагируют на воспалительные цитокины (IL-7, IL-12, IL-15, IL-18, IFN-α/β). Инфицированные клетки слизистых представляют АГ MAIT-клеткам, которые лизируют бактериально-инфицированные клетки, используя гранзим B. MAIT так же вырабатывают провоспалительные цитокины и цитокины, активирующие адаптивный иммунитет, формируют иммунную память. При всех этих процессах необходимо большое количество витамина В2 (рибофлавин).
Резидентные в ткани NK (trNK) клетки. Клетки trNK были выделены из NK-клеток и считаются «врожденными аналогами» T-RM-клеток. Впервые описаны в печени. В дальнейшем дифференцируются в матке, коже, почках, легких и жировой ткани. Подмножество клеток trNK представляет собой CD56bright-клетки, экспрессируют Ig-подобный рецептор киллерных клеток (KIR), с низким уровнем CD16, CD57 и перфорина. Они продуцируют высокие уровни воспалительных цитокинов, таких как IFNγ, TNF и GM-CSF, плохо дегранулируют при стимуляции. Этот тип клеток был идентифицирован на границе раздела матери и плода. Их уменьшение ухудшает развитие плода и приводит к задержке роста плода.
К клеткам, обладающим защитными свойствами, имеет смысл отнести и многочисленные секреторные клетки вырабатывают вещества различной химической природы. Так, например, в кишечнике функционально схожие с нейтрофилами клетки Панета под воздействием бактерий или бактериальных антигенов секретируют антимикробные пептиды (дефензины, лизоцим и фосфолипазу A2) в просвет кишечной железы, тем самым способствуя поддержанию желудочно-кишечного барьера.